Какова температура кипения железа
Какая температура плавления железа
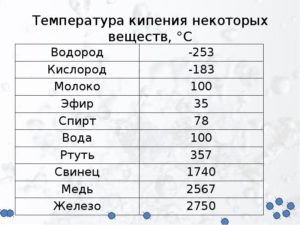
Металлы плавятся, как правило, при очень высокой температуре, которая может достигать более 3 тыс. градусов. Хотя некоторые из них можно расплавить в домашних условиях, например, свинец или олово. А вот ртуть плавят при температуре минус 39 градусов.
В домашних условиях этого добиться не удастся. Температура плавления — это один из важных показателей производства не только самого металла, но и его сплавов. Выплавляя сырье, специалисты учитывают и другие физические и химические свойства руды и металла.
Железо и его свойства
Железо — это химический элемент, который в таблице Менделеева находится под номером 26. Это один из самых распространенных элементов во всей Солнечной системе. Согласно материалам исследований, в составе ядра Земли находится примерно 79−85% этого вещества. В земной коре его тоже присутствует большое количество, но оно уступает алюминию.
В чистом виде металл имеет белый цвет с чуть серебристым оттенком. Он пластичен, но имеющиеся в нем примеси могут определять его физические свойства. Реагирует на магнит.
Железо присутствует в воде. В речных водах его концентрация равна примерно 2 мг/л металла. В морской воде его содержание может быть ниже в сто или даже тысячу раз.
Оксид железа — это основная форма, добыча которой осуществляется и которая находится в природе. Оксидное железо может располагаться в самой верхней части земной коры и быть составляющей осадочных образований.Элемент, находящийся на двадцать шестом месте в таблице Менделеева, может иметь несколько степеней окисления. Именно они определяют его геохимическую особенность нахождения в определенной среде. В ядре Земли металл присутствует в нейтральной форме.
Добыча полезных ископаемых
Руд, в которых присутствует железо, существует несколько. Однако, в качестве сырья для производства железа в промышленности используют в основном следующие:
- магнезитовую руду;
- гетитовую руду;
- гематитовую руду.
А также часто встречаются такие разновидности руды:
- леллингит;
- сидерит;
- марказит;
- ильменит;
- ярозит.
Существует еще минерал под названием мелантерит. Его используют преимущественно в фармацевтической промышленности. Из себя он представляет зелёного цвета хрупкие кристаллы, в которых присутствует стеклянный блеск. Из него производят лекарственные препараты, в составе которых имеется ферум.
Основным месторождением этого металла является Южная Америка, а именно Бразилия.
Плавление железа и необходимая температура
Точкой плавления металла называют такую минимальную температуру, при которой он переходит из твердого состояния в жидкое. При этом в объеме он практически остается неизменным.
Металл могут производить из руды различными способами, но самый основной из них — это доменный. Помимо доменного, используют еще выплавку железа при помощи обжига измельченной руды с примесью глины. Из полученной смеси формируют окатыши, которые обрабатываются в печи с последующим восстановлением водородом. Далее плавление железа осуществляется в электрической печи.
Температура плавления железа весьма высока. Для технически чистого элемента она составляет +1539 °C. В этом веществе присутствует примесь — Сера, которую можно извлечь лишь в жидком виде. Без примесей чистый материал получают при электролизе солей металла.
Классификация металлов по температуре плавления
Разные металлы могут переходить в жидкое состояние при разной температуре. Вследствие этого выделяют определённую классификацию. Их делят следующим образом:
- Легкоплавкие — те элементы, которые могут становиться жидкими уже при температуре ниже 600 градусов. К ним относят цинк, олово, свинец и пр. Их можно расплавить даже в домашних условиях — просто нужно разогреть при помощи плиты или паяльника. Такие виды нашли применение в технике и электронике. Они используются для соединения элементов из металла и движения электрического тока. Олово плавится при 232 градусах, а цинк — при 419 градусах.
- Среднеплавкие — элементы, которые начинают расплавляться при температуре от шестисот до тысячи шестисот градусов. Эти элементы используют по большей части для строительных элементов и металлоконструкций, то есть при создании арматур, плит и строительных блоков. В эту группу входят: железо, медь, алюминий. Температура плавления алюминия сравнительно низка и составляет 660 градусов. А вот железо начинает переходить в жидкое состояние лишь при температуре 1539 градусов. Это один из самых распространенных металлов, используемых в промышленности, особенно в автомобильной. Однако железо подвержено коррозии, то есть ржавчине, поэтому ему требуется специальная поверхностная обработка. Его необходимо покрывать краской или олифой, и не допускать попадание влаги.
- Тугоплавкие — это такие материалы, которые расплавляются и становятся жидкими при температуре выше 1600 градусов. В эту группу относят вольфрам, титан, платину, хром и т. п. Они используются в ядерной промышленности и для некоторых машинных деталей. Они могут применяться для расплавки других металлов, изготовления высоковольтных проводов или проволоки. Платину можно расплавить при 1769 градусах, а вольфрам — при 3420 °C.
Источник: https://MyTooling.ru/instrumenty/kakaja-temperatura-plavlenija-zheleza
Какова температура кипения железа
Температура плавления химически чистого железа составляет 1539 о С. Технически чистое железо, полученное в результате окислительного рафинирования, содержит некоторое количество растворенного в металле кислорода. По этой причине температура его плавления понижается до 1530 о С.
Температура плавления стали всегда ниже температуры плавления железа в связи с наличием в ней примесей. Растворенные в железе металлы (Mn, Cr, Ni. Co, Mo, V и др.) понижают температуру плавления металла на 1 – 3 о С на 1% введенного элемента, а элементы из группы металлоидов (C, O, S, P и др.) на 30 – 80 о С.
На протяжении большей части общей продолжительности плавки температура плавления металла изменяется главным образом в результате изменения содержания углерода. При концентрации углерода 0,1 – 1,2%, которая характерна для доводки плавки в сталеплавильных агрегатах, температуру плавления металла с достаточной для практических целей точностью можно оценить из уравнения
Теплота плавления железа составляет 15200 Дж/моль или 271,7 кДж/кг.
Температура кипения железа в изданиях последних лет приводится равной 2735 о С. Однако, опубликованы результаты исследований, согласно которым температура кипения железа значительно выше (до 3230 о С).
Теплота испарения железа составляет 352,5 кДж/моль или 6300 кДж/кг.
Давление насыщенного пара железа (PFe, Па) можно оценить при помощи уравнения
где Т – температура металла, К.
Результаты расчета давления насыщенного пара железа при различных температурах, а также содержания пыли в окислительной газовой фазе над металлом (X, г/м 3 ) представлены в таблице 1.1.
Таблица 1.1 – Давление насыщенного пара железа и запыленность газов при разных температурах
Согласно существующим санитарным нормам содержание пыли в газах, которые выбрасываются в атмосферу, не должно превышать 0,1 г/м 3 . Из данных таблицы 1.1 видно, что при 1600 о С запыленность газов над открытой поверхностью металла выше допустимых значений. Поэтому обязательно требуется очистка газов от пыли, состоящей в основном из оксидов железа.
Динамическая вязкость. Коэффициент динамической вязкости жидкости () определяется из соотношения
где F – сила взаимодействия двух движущихся слоев, Н;
S – площадь соприкосновения слоев, м 2 ;
– градиент скорости слоев жидкости по нормали к направлению потока, с -1 .
Динамическая вязкость сплавов железа обычно изменяется в пределах 0,001 – 0,005 Па•с. Ее величина зависит от температуры и содержания примесей, главным образом углерода. При перегреве металла над температурой плавления выше 25 – 30 о С влияние температуры не существенно.
Кинематическая вязкость жидкости представляет собой скорость передачи импульса в потоке единичной массы. Ее величина определяется из уравнения
где – плотность жидкости, кг/м 3 .
Величина динамической вязкости жидкого железа близка к 6•10 -7 м 2 /с.
Плотность железа при 1550 – 1650 о С равна 6700 – 6800 кг/м 3 . При температуре кристаллизации плотность жидкого металла близка к 6850 кг/м 3 . Плотность твердого железа при температуре кристаллизации равна 7450 кг/м 3 , при комнатной температуре – 7800 кг/м 3 .
Из обычных примесей наибольшее влияние на плотность расплавов железа оказывают углерод и кремний, понижая ее. Поэтому обычного состава жидкий чугун имеет плотность 6200 – 6400 кг/м 3 , твердый при комнатной температуре – 7000 – 7200 кг/м 3 .
Читать еще: Масляная станция своими руками
Плотность жидкой и твердой стали занимает промежуточное положение между плотностями железа и чугуна и составляет соответственно 6500 – 6600 и 7500 – 7600 кг/м 3 .
Удельная теплоемкость жидкого металла практически не зависит от температуры. В оценочных расчетах величину ее можно принимать равной 0,88 кДж/(кг•К) для чугуна и 0,84 кДж/(кг•К) для стали.
Поверхностное натяжение железа имеет максимальное значение при температуре около 1550 о С. В области более высоких и низких температур величина его уменьшается. Это отличает железо от большинства металлов, для которых характерно понижение поверхностного натяжения при повышении температуры.
Поверхностное натяжение жидких сплавов железа существенно меняется в зависимости от химического состава и температуры. Обычно оно изменяется в пределах 1000 – 1800 мДж/м 2 (рисунок 1.1).
Рисунок 1.1 – Влияние примесей на величину поверхностного натяжения сплавов железа
Растворимость. Весьма ограниченную растворимость в жидком и твердом железе имеют щелочные (Li, Na, K, Rb, Cs) и щелочноземельные (Mg, Ca, Ba, Sr) металлы. Кроме того практически нерастворимыми являются Ag, Cd и Bi.
К числу металлов, имеющих неограниченную растворимость в железе, относятся Mn, Ni, Co, Cu, Al, Sb, Ce и все редкоземельные металлы.
Ограниченной растворимостью в железе обладают Cr, V, Mo, W, Ti, Zr, Pb, Sn, Pt и др. Но при высоких температурах все металлы этой группы, кроме Pb и Sn, растворяются в расплавах железа в неограниченных количествах.
Физические характеристики, состав и особенности металла железа
Железо – первый по значимости и распространенности конструкционный материал.
Известен он с глубокой древности, а свойства его таковы, что когда железо научились выплавлять в значимом количестве, металл вытеснил все остальные сплавы.
Наступил век железа и, судя по области его применения, время это закончится нескоро. Данная статья расскажет вам, какова удельная плотность железа, какая у него температура плавления в чистом виде.
Состав и структура железа
Железо – типичный металл, причем химически активный. Вещество вступает в реакцию при нормальной температуре, а нагрев или повышение влажности значительно увеличивают его реакционноспособность. Железо корродирует на воздухе, горит в атмосфере чистого кислорода, а в виде мелкой пыли способно воспламениться и на воздухе.
Чистому железу присуща ковкость, однако в таком виде металл встречается очень редко. На деле под железом подразумевают сплав с небольшими долями примесей – до 0,8%, которому присущи мягкость и ковкость чистого вещества. Значение для народного хозяйства имеет сплавы с углеродом – сталь, чугун, нержавеющая сталь.
Железу присущ полиморфизм: выделяют целых 4 модификации, отличающиеся структурой и параметрами решетки:
- α-Fe – существует от нуля до +769 С. Имеет объемно-центрированную кубическую решетку и является ферромагнетиком, то есть, сохраняет намагниченность в отсутствие внешнего магнитного поля. +769 С – точки Кюри для металла;
- от +769 до +917 С появляется β-Fe. От α-фазы она отличается лишь параметрами решетки. Практически все физические свойства при этом сохраняются за исключением магнитных: железо становится парамагнетиком, то есть, способность намагничиваться оно утрачивает и втягивается в магнитное поле. Металловедение β-фазу как отдельную модификацию не рассматривает. Поскольку переход не влияет на значимые физические характеристики;
- в диапазоне от 917 до 1394 С существует γ-модификация, которой присуща гранецентрированная кубическая решетка;
- при температуре выше +1394 С появляется δ-фаза, для которой характерна объемно-центрированная кубическая решетка.
Читать еще: Сварка газовых труб электросваркой
Температура фазовых переходов заметно изменяется при легировании тем же углеродом. Собственно, сама способность железа образовать столько модификаций служит основой обработки стали в разных температурных режимах. Без таких переходов металл не получил бы столь широкого распространения.
Теперь настал черед свойств металла железа.
О структуре железа рассказывает этот видеосюжет:
Свойства и характеристики металла
Железо – достаточно легкий, умеренно тугоплавкий металл, серебристо-серого цвета. Легко реагирует с разбавленными кислотами и поэтому считается элементом средней активности. На воздухе – сухом, металл постепенно покрывается пленкой оксида, которая препятствует дальнейшей реакции.
Но при самой небольшой влажности вместо пленки появляется ржавчина – рыхлая и неоднородная по составу. Ржавчина дальнейшей коррозии железа не препятствует. Однако физические свойства металла, а, главное, его сплавов с углеродом таковы, что, несмотря на низкую коррозийную стойкость, использование железа более чем оправдано.
Далее вы узнаете, чему равна плотность железа (в кг на м3) в сравнении, например, с медью или алюминием.
Масса и плотность
Молекулярная масса железа составляет 55,8, что указывает на относительную легкость вещества. А какая же у железа плотность? Такой показатель определяется фазовой модификацией:
- α-Fe – 7,87 г/куб. см при 20 С, и 7,67 г/куб. см при 600 С;
- γ-фаза отличается еще более низкой плотностью – 7,59 г/куб см при 1000С;
- плотность δ-фазы составляет 7,409 г/куб см.
С повышением температуры плотность железа закономерно падает.
А теперь давайте узнаем, какова температура плавления железа по Цельсию, сравнивая ее, например, с медью или чугуном.
Температурный диапазон
Металл относится к умеренно тугоплавким, что означает сравнительно невысокую температуру изменения агрегатного состояния:
Таблица температур плавления металлов
Каждый металл или сплав обладает уникальными свойствами, в число которых входит температура плавления. При этом объект переходит из одного состояния в другое, в конкретном случае становится из твёрдого жидким.
Чтобы его расплавить, необходимо подвести к нему тепло и нагревать до достижения нужной температуры. В момент, когда достигается нужная точка температуры данного сплава, он ещё может остаться в твёрдом состоянии.
При продолжении воздействия начинает плавиться.
Наиболее низкая температура плавления у ртути — она плавится даже при -39 °C, самая высокая у вольфрама — 3422 °C. Для сплавов (стали и других) определить точную цифру крайне сложно. Все зависит от соотношения компонентов в них. У сплавов она записывается как числовой промежуток.
Как происходит процесс
Элементы, какими бы они ни были: золото, железо, чугун, сталь или любой другой — плавятся примерно одинаково. Это происходит при внешнем или внутреннем нагревании.
Внешнее нагревание осуществляется в термической печи. Для внутреннего применяют резистивный нагрев, пропуская электрический ток или индукционный нагрев в электромагнитном поле высокой частоты.
Воздействие при этом примерно одинаковое.
Когда происходит нагревание, усиливается амплитуда тепловых колебаний молекул. Появляются структурные дефекты решётки, сопровождаемые разрывом межатомных связей. Период разрушения решётки и скопления дефектов и называется плавлением.
В зависимости от градуса, при котором плавятся металлы, они разделяются на:
- легкоплавкие — до 600 °C: свинец, цинк, олово;
- среднеплавкие — от 600 °C до 1600 °C: золото, медь, алюминий, чугун, железо и большая часть всех элементов и соединений;
- тугоплавкие — от 1600 °C: хром, вольфрам, молибден, титан.
Читать еще: Как отпустить металл в домашних условиях
В зависимости от того, каков максимальный градус, подбирается и плавильный аппарат. Он должен быть тем прочнее, чем сильнее будет нагревание.
Вторая важная величина — градус кипения. Это параметр, при достижении которого начинается кипение жидкостей. Как правило, она в два раза выше градуса плавления. Эти величины прямо пропорциональны между собой и обычно их приводят при нормальном давлении.
Если давление увеличивается, величина плавления тоже увеличивается. Если давление уменьшается, то и она уменьшается.
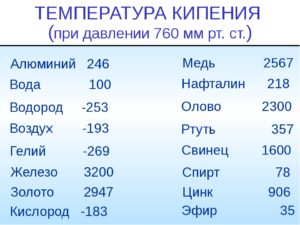
Таблица характеристик
Металлы и сплавы — непременная основа для ковки, литейного производства, ювелирной продукции и многих других сфер производства. Чтобы не делал мастер (ювелирные украшения из золота, ограды из чугуна, ножи из стали или браслеты из меди), для правильной работы ему необходимо знать температуры, при которых плавится тот или иной элемент.
Чтобы узнать этот параметр, нужно обратиться к таблице. В таблице также можно найти и градус кипения.
Среди наиболее часто применяемых в быту элементов показатели температуры плавления такие:
- алюминий — 660 °C;
- температура плавления меди — 1083 °C;
- температура плавления золота — 1063 °C;
- серебро — 960 °C;
- олово — 232 °C.
Олово часто используют при пайке, так как температура работающего паяльника составляет как раз 250–400 градусов;
- свинец — 327 °C;
- температура плавления железо — 1539 °C;
- температура плавления стали (сплав железа и углерода) — от 1300 °C до 1500 °C.
Она колеблется в зависимости от насыщенности стали компонентами;
- температура плавления чугуна (также сплав железа и углерода) — от 1100 °C до 1300 °C;
- ртуть — -38,9 °C.
Как понятно из этой части таблицы, самый легкоплавкий металл — ртуть, которая при плюсовых температурах уже находится в жидком состоянии.
Градус кипения всех этих элементов почти вдвое, а иногда и ещё выше градуса плавления. Например, у золота он 2660 °C, у алюминия— 2519 °C, у железа — 2900 °C, у меди — 2580 °C, у ртути — 356,73 °C.
У сплавов типа стали, чугуна и прочих металлов расчёт примерно такой же и зависит от соотношения компонентов в сплаве.
Максимальная температура кипения у металлов — у рения— 5596 °C. Наибольшая температура кипения — у наиболее тугоплавящихся материалов.
Бывают таблицы, в которых также указана плотность металлов. Самым лёгким металлом является литий, самым тяжёлым — осмий. У осмия плотность выше, чем у урана и плутония, если рассматривать её при комнатной температуре.К лёгким металлам относятся: магний, алюминий, титан. К тяжёлым относится большинство распространённых металлов: железо, медь, цинк, олово и многие другие. Последняя группа — очень тяжёлые металлы, к ним относятся: вольфрам, золото, свинец и другие.
Ещё один показатель, встречающийся в таблицах — это теплопроводность металлов. Хуже всего тепло проводит нептуний, а лучший по теплопроводности металл — серебро. Золото, сталь, железо, чугун и прочие элементы находится посередине между этими двумя крайностями. Чёткие характеристики для каждого можно найти в нужной таблице.
Источник: https://klarus-auto.ru/svarka/kakova-temperatura-kipeniya-zheleza.html
Какова температура кипения железа? —
Какова температура кипения железа?
- Температура кипения железа очень высока, многое конечно зависит от самого сплава, ведь состав сплава может быть различный. Но принято полагать, что при температуре 1539 C железо только начинает плавиться, а вот кипеть железо уже начинает при температуре — 2862 C.
- Человечество давно освоило железо. Наши далекие предки перешли на железные орудия труда, по достоинству оценив все его преимущества перед камнем и бронзой. Железо осваивалось на нашей планете разными народами очень и очень давно. Сейчас же оно считается одним из главных среди металлов, однако используется железо, как правило, в виде сплавов. В зависимости от состава этого сплава, железо может плавиться и кипеть при разной температуре. Принято считать, что плавиться железо начинает при температуре около 1535 градусов, а вот кипеть при температуре около 3200 градусов.
- 2 862C, хотя я в этом не спец. понимаете, есть разные сплавы, идеального метала быть не может. Также к плюсу действует еще и давление
- Чистое в химическом смысле железо плавится при 1539 градусах по Цельсию. Получить его сложно, а присутствующее обычно некоторое количество кислорода снижает это значение до 1530 градусов.Если в железе присутствуют другие металлы, марганец, хром, никель, то говорить нужно о стали. Каждый процент этих примесей в составе железа уменьшает температуру плавления на 30 градусов.Элементы металлоидной группы, фосфор, сера, углерод, понижают е до 80 градусов на каждый процент.Температуру кипения железа ранее считали равной 2735 градусам, но последние исследования дают другую цифру, до 3230 градусов.
- Температура кипения железа довольно высокая. Плавится железо начинает при 1539 градусах по Цельсию. Температура кипения зависит еще и от примесей или сплава железа, поскольку в чистом виде оно практически не бывает, поэтому может быть в пределах от 2800 до 3200 градусов по Цельсию.
- Железо это металл, который обладает огромнм количеством свойств, но основное из них, которое очень полезно человечеству является полморфизм. Именно, благодаря нему железо используют в металлургии и может плавиться.Железо это умеренно тугоплавкий металл. Температура плавления — 1539 C, температура кипения — 2862 C.
- Температура кипения железа достаточно высока, как правило, кипит оно при температуре порядка 2 750 — 2 850 градусов по Цельсию. Хотя исследования последних лет говорят, что температура кипения железа значительно выше — до 3230 градусов.
- Железо кипит при 2750 градусах по Цельсию.Однако нужно понимать, что многое зависит от такого фактора, как давление.Так, чем выше давление, тем выше и температура кипения какого-либо вещества.По этой причине, например, на вершине Эльбруса температура кипения воды равна не привычным ста градусам, а 82С.
- Железо это ковкий металл бело-серебристого цвета. Обычно, железом называют его сплавы с небольшим содержанием примесей, которые сохраняют пластичность и мягкость чистого железа. Сплавы железа с углеродом применяются чаще всего. Это сталь и чугун. Температура кипения железа наступает при достижении отметки 2861 градус Цельсия.
- Железо бывает разным ведь оно тоже часто состоит из разных сплавов по этому трудно с уверенностью назвать температуру кипения железа, но примерные цифры это порядка 2 750 — 2 850 градусов по Цельсию, но есть данные и о том что температура кипения гораздо выше.
- У железа температура кипения довольно-таки высока. Так сам процесс плавления уже начинается при температуре начиная от 1539-ти градусов по Цельсию. А вот процесс кипения у железа начинается при более внушительной температуре, равной 2862 градусам. Однако при наличии разных примесей температура может отклоняться от указанного значения.
{«p.
;:»article»,»articleContent»:{«contentState»:»{\»blocks\»:[{\»data\»:{},\»depth\»:0,\»entityRanges\»:[],\»inlineStyleRanges\»:[],\»text\»:\» Всем привет, сегодня мы с вами рассмотрим такой вопрос. Какова температура кипения железа.
\»,\»type\»:\»blockquote\»,\»key\»:\»5trq3\»},{\»data\»:{\»image\»:{\»id\»:\»5a13f8ea8c8be3bfd4f17e36\»}},\»depth\»:0,\»entityRanges\»:[],\»inlineStyleRanges\»:[],\»text\»:\»\»,\»type\»:\»atomic:image\»,\»key\»:\»b549o\»},{\»data\»:{},\»depth\»:0,\»entityRanges\»:[],\»inlineStyleRanges\»:[],\»text\»:\»Железо это ковкий металл бело-серебристого цвета.
ычно, железом называют его сплавы с небольшим содержанием примесей, которые сохраняют пластичность и мягкость чистого железа. Человечество давно освоило железо. Наши далекие предки перешли на железные орудия труда, по достоинству оценив все его преимущества перед камнем и бронзой. Железо осваивалось на нашей планете разными народами очень и очень давно.
Сейчас же оно считается одним из главных среди металлов, однако используется железо, как правило, в виде сплавов. В зависимости от состава этого сплава, железо может плавиться и кипеть при разной температуре.
Принято считать, что плавиться железо начинает при температуре около 1535 градусов, а вот кипеть при температуре около 2 862 градусов. \»,\»type\»:\»unstyled\»,\»key\»:\»2s8ea\»},{\»data\»:{\»embedData\»:{\»type\»:\»\»,\»postUrl\»:\»https://youtu.
be/9z3Az8lya5Q\»}},\»depth\»:0,\»entityRanges\»:[],\»inlineStyleRanges\»:[],\»text\»:\»\»,\»type\»:\»atomic:embed\»,\»key\»:\»1pg3\»},{\»data\»:{},\»depth\»:0,\»entityRanges\»:[],\»inlineStyleRanges\»:[],\»text\»:\»\»,\»type\»:\»marker\»,\»key\»:\»ykHjC5AnFwQZ7P9XZUhh\»}],\»entityMap\»:{}}»},»preview»:{«image»:{«id»:»5a13f8ea8c8be3bfd4f17e36″},»title»:»Какова температура кипения железа?»,»snippet»:»Всем привет, сегодня мы с вами рассмотрим такой вопрос.
кова температура кипения железа.Железо это ковкий металл бело-серебристого цвета. Обычно, железом называют его сплавы с небольшим содержанием примесей, которые сохраняют пластичность и мягкость чистого железа. Человечество давно освоило железо. Наши далекие предки перешли на железные орудия труда, по достоинству оценив все его преимущества»},»modTime»:1511258367842},»titleForUrl»:»kakova-temperatura-kipeniia-jeleza»,»itemId»:»5114968758390706242″,»publisherItemId»:»7689665743191820082″,»adsFlagState»:»unavailable»,»commentsFlagState»:»unavailable»},»images»:{«5a13f753248090f4a1e45a98»:{«id»:»5a13f753248090f4a1e45a98″,»namespace»:»zen-logos»,»groupId»:246004,»imageName»:»pub_5a00b8f39d5cb36291715bc2_5a13f753248090f4a1e45a98″,»meta»:{«mainColor»:»#060F1B»,»origFormat»:»JPEG»},»sizes»:{«xh»:{«width»:208,»height»:208},»min_m»:{«width»:60,»height»:60},»min_xxh»:{«width»:160,»height»:160},»orig»:{«width»:300,»height»:300},»min_xh»:{«width»:120,»height»:120},»h»:{«width»:156,»height»:156},»xxh»:{«width»:300,»height»:300},»min_h&.
ht»:232},»smart_crop_344x194″:{«width»:344,»height»:194},»smart_crop_112x132″:{«width»:112,»height»:132},»smart_crop_300x300″:{«width»:300,»height»:300},»smart_crop_low_344x194″:{«width»:344,»height»:194},»smart_crop»:{«width»:352,»height»:216},»scale_600″:{«width»:600,»height»:338},»smart_crop_low_blur_112x132″:{«width»:112,»height»:132},»scale_720″:{«width»:720,»height»:405},»smart_crop_32x18″:{«width»:32,»height»:18},»smart_crop_336x116″:{«width»:336,»height»:116},»smart_crop_387x455″:{«width»:387,»height»:455},»smart_crop_408x408″:{«width&q.
th»:244,»height»:405},»scale_540″:{«width»:540,»height»:304},»smart_crop_low_112x132″:{«width»:112,»height»:132},»scale_360″:{«width»:360,»height»:203},»smart_crop_378x196″:{«width»:378,»height»:196},»smart_crop_231x155″:{«width»:231,»height»:155},»smart_crop_688x387″:{«width»:688,»height»:387},»orig»:{«width»:1920,»height»:1080},»smart_crop_352x150″:{«width»:352,»height»:150},»smart_crop_204x204″:{«width»:204,»height»:204},»smart_crop_low_blur_344x194″:{«width»:344,»height»:194},»smart_crop_154x103″:{«width»:154,»height»:103},»smart_crop_low_3.
e=»display: none» hidden> {} {} {«avatarsHost»:»avatars.mds.yandex.net»,»advHostname»:»zenadservices.net»,»disableUploadVideo»:true,»disableUploadGif»:true,»disableNarrativeCreation»:false,»disableNicknamesAndDomainsChanging»:false,»extendVideoHost»:»zpub-upload.kaizen.yandex.ru»,»showAdvancedStatistic»:true,»showAdvancedStatisticFromTs»:1511730000000,»showAdvancedStatisticNarrative»:true,»showAdvancedStatisticNarrativeFromTs»:1518048000000,»autoHideFirstSlideNarrative»:false,»disablePublicationPixels»:true,»showNarrativeFullScreen»:true,»disableTagsWriting»:false,»minPi.
0c5dca3b9657a6f4614d68ec24587a:1533300553588 {} false false
Физические и химические свойства железа
- Химический элемент № 26 является самым распространенным в Солнечной системе. По данным исследований содержание железа в ядре Земли составляет 79–85,5%. По распространенности в коре планеты оно уступает только алюминию.
- Металл в чистом виде имеет белый цвет с серебристым оттенком, отличается пластичностью. Наличие примесей определяет его физические параметры. Железу свойственно реагировать на магнит.
- Для этого химического элемента характерен полиморфизм, который имеет место при нагревании. Повышенная концентрация металла наблюдается в местах извержения пород. Промышленные месторождения формируются в результате внешних и внутренних процессов, происходящих в земной коре.
- В речной воде содержится приблизительно 2 мг/л металла, а показатель для морской воды меньше в 100–1000 раз.
- Железо имеет несколько степеней окисления, определяющих его геохимическую особенность нахождения в определенной среде. В нейтральной форме металл находится в ядре Земли.
- Оксид железа является основной формой нахождения в природе, а оксидное железо размещается в самой верхней части земной коры в составе осадочных образований.
- химического элемента № 26 в минералах с нестабильным составом увеличивается с уменьшением температурного градиента. Кипение происходит при нагревании до + 2861 °C. Удельная теплота плавления составляет 247,1 КДж/кг.
Добыча металла
Среди руд, содержащих железо, сырьем для промышленного производства являются:
- гематит;
- гетит;
- магнетит.
Гетит и гидрогетит формируют образования в коре выветривания, размером сотни метров. В зоне шельфа и озерах коллоидные растворы минералов в результате осаждения образуют оолиты (бобовые железные руды).
Пирит и пирротин, широко распространенные в природе минералы железа, используются в качестве сырья для производства серной кислоты.
К часто встречающимся минералам железа относятся также:
- сидерит;
- леллингит;
- марказит;
- ильменит;
- ярозит.
Минерал мелантерит, представляющий собой хрупкие зеленые кристаллы со стеклянным блеском, используется в фармацевтической промышленности для производства железосодержащих препаратов.
Основное месторождение этого металла находится в Бразилии. В последнее время внимание сосредоточивается на разработке конкреций, присутствующих на морском дне, в которых содержатся железо и марганец.
Плавление железа
От чего зависит температура плавления железа?
Производство металла предусматривает различные технологии его извлечения из рудного сырья. Наиболее распространена выплавка железа доменным способом.
Перед тем как выплавлять металл, его восстанавливают в печи при температуре +2000 °C. Для извлечения примесей добавляется флюс, разлагающийся при нагревании до оксида с последующим соединением с диоксидом кремния и образованием шлака.
Кроме доменного способа выплавка железа производится путем обжига измельченной руды с глиной. Из смеси формируются окатыши и обрабатываются в печи с восстановлением водородом. Дальнейшая плавка железа производится в электрических печах.
Свойства металла зависят от чистоты материала. Для технически чистого железа температура плавления составляет +1539 °C. Сера является вредной примесью. Извлечь ее можно только из жидкого раствора. Химически чистый материал получают в результате электролиза солей металла.
Сплавы металла
В чистом виде этот материал мягкий, поэтому для повышения прочности в состав вводят углерод.
В металлургии сплавы железа называют черными металлами.
В зависимости от компонентов лигатуры меняются свойства материалов. Температура плавления железа также меняется при наличии лигатурных компонентов.
Удельная теплота плавления стали равна 84 кДж. Этот показатель обозначает, что при температуре плавления стали для перевода 1 кг сплава из кристаллического в жидкое состояние необходимо 84 кДж энергии.
Соединения из различных металлов образуют сплавы. Удельная теплота плавления чугуна составляет 96–140 кДж. Чугун содержит до 4% углерода, 1,5% марганца, до 4,5% кремния и примеси в виде серы и фосфора. Различают белый и серый сплавы.В белом часть углерода находится в соединении карбида железа. Такой сплав отличается хрупкостью и твердостью. Он предназначается для изготовления конструкций и деталей.
Серый сплав, содержащий углерод в виде графита, легко поддается обработке. Чугун выплавляют из железной руды в доменных печах. Плавление руды сопровождается восстановительной реакцией железа из оксидов углеродом.
Большинство веществ может плавиться с увеличением объема при нагревании. Для чугуна объемом 1000 см³ этот показатель составляет 988–994 см³.
Чугун является сырьем для производства стали, отличающейся содержанием углерода (не выше 2,14%).
По химическому составу различают сталь:
- легированную;
- углеродистую.
Углеродистая сталь содержит примеси серы, фосфора и кремния. Она отличается низкими электротехническими свойствами, низкой прочностью, легко поддается процессу коррозии.
Наличие лигатурных добавок придает стали новые технические свойства. В качестве дополнительных компонентов используют:
- молибден;
- никель;
- вольфрам;
- хром;
- ванадий.
В состав высоколегированной стали входит не более 10% добавок. Сплав отличается прочностью. Технология производства стали из чугуна позволяет получить высококачественный материал для производства:
- металлических конструкций;
- резервуаров;
- посуды;
- армирующих деталей;
- электрооборудования.
В качестве сырья сталь используется в разных отраслях промышленности. Без нее невозможно представить авиастроение, кораблестроение, автомобильную отрасль и многие другие производственные сферы.
Источник: https://novoevmire.biz/obshhestvo/nauka/a-rel-home-href-https-inlove-kz-video-a.html
Физические характеристики, состав и особенности металла железа

Железо – первый по значимости и распространенности конструкционный материал.
Известен он с глубокой древности, а свойства его таковы, что когда железо научились выплавлять в значимом количестве, металл вытеснил все остальные сплавы.
Наступил век железа и, судя по области его применения, время это закончится нескоро. Данная статья расскажет вам, какова удельная плотность железа, какая у него температура плавления в чистом виде.
Железо – типичный металл, причем химически активный. Вещество вступает в реакцию при нормальной температуре, а нагрев или повышение влажности значительно увеличивают его реакционноспособность. Железо корродирует на воздухе, горит в атмосфере чистого кислорода, а в виде мелкой пыли способно воспламениться и на воздухе.
Чистому железу присуща ковкость, однако в таком виде металл встречается очень редко. На деле под железом подразумевают сплав с небольшими долями примесей – до 0,8%, которому присущи мягкость и ковкость чистого вещества. Значение для народного хозяйства имеет сплавы с углеродом – сталь, чугун, нержавеющая сталь.
Железу присущ полиморфизм: выделяют целых 4 модификации, отличающиеся структурой и параметрами решетки:
- α-Fe – существует от нуля до +769 С. Имеет объемно-центрированную кубическую решетку и является ферромагнетиком, то есть, сохраняет намагниченность в отсутствие внешнего магнитного поля. +769 С – точки Кюри для металла;
- от +769 до +917 С появляется β-Fe. От α-фазы она отличается лишь параметрами решетки. Практически все физические свойства при этом сохраняются за исключением магнитных: железо становится парамагнетиком, то есть, способность намагничиваться оно утрачивает и втягивается в магнитное поле. Металловедение β-фазу как отдельную модификацию не рассматривает. Поскольку переход не влияет на значимые физические характеристики;
- в диапазоне от 917 до 1394 С существует γ-модификация, которой присуща гранецентрированная кубическая решетка;
- при температуре выше +1394 С появляется δ-фаза, для которой характерна объемно-центрированная кубическая решетка.
При высоком давлении, а также при легировании металла некоторыми добавками образуется ε- фаза с гексагонической плотноупакованной решеткой.
Температура фазовых переходов заметно изменяется при легировании тем же углеродом. Собственно, сама способность железа образовать столько модификаций служит основой обработки стали в разных температурных режимах. Без таких переходов металл не получил бы столь широкого распространения.
Теперь настал черед свойств металла железа.
О структуре железа рассказывает этот видеосюжет:
Железо – достаточно легкий, умеренно тугоплавкий металл, серебристо-серого цвета. Легко реагирует с разбавленными кислотами и поэтому считается элементом средней активности. На воздухе – сухом, металл постепенно покрывается пленкой оксида, которая препятствует дальнейшей реакции.
Но при самой небольшой влажности вместо пленки появляется ржавчина – рыхлая и неоднородная по составу. Ржавчина дальнейшей коррозии железа не препятствует. Однако физические свойства металла, а, главное, его сплавов с углеродом таковы, что, несмотря на низкую коррозийную стойкость, использование железа более чем оправдано.Далее вы узнаете, чему равна плотность железа (в кг на м3) в сравнении, например, с медью или алюминием.
Теплоемкость и теплопроводность
Как и всякий металл, железо проводит тепло, хотя показатели его в этой области невысоки: по теплопроводности металл уступает алюминию – в 2 раза меньше, и меди – в 5 раз.
Теплопроводность при 25 С составляет 74,04 вт/(м·К). Величина зависит от температуры;
- при 100 к теплопроводность составляет 132 [Вт/(м.К)];
- при 300 К – 80,3 [Вт/(м.К)];
- при 400 – 69,4 [Вт/(м.К)];
- а при 1500 – 31,8 [Вт/(м.К)].
Важно:
- Коэффициент температурного расширения при 20 С – 11,7·10-6.
- Теплоемкость металла определяется его фазовой структурой и довольно сложно зависит от температуры. С повышением до 250 С, теплоемкость медленно увеличивается, затем резко возрастает до достижения точки Кюри, а потом начинается снижаться.
- Удельная теплоемкость в температурном диапазоне от 0 до 1000С составляет 640,57 дж/(кг·К).
Электропроводность
Железо проводит ток, но далеко не так хорошо, как медь и серебро. Удельное электрическое сопротивление металла при нормальных условиях – 9,7·10-8 ом·м.
Поскольку железо является ферромагнетиком, его показатели в этой области более значимы:
- магнитная индукция насыщения составляет 2,18 Тл;
- магнитная проницаемость – 1,45.106.
Далее рассмотрена токсичность железа.
Металл не представляет опасности для человеческого организма.
Процессы производства стали и изготовления изделий из железа могут быть опасными, но только за счет высоких температур и тех добавок, которые используют при производстве различных сплавов.
Отходы железа – металлолом, представляют опасность для окружающей среды, но вполне умеренную, поскольку металл ржавеет на воздухе.
Железо не обладает биологической инертностью, поэтому как материал для протезирования не используется. Однако в человеческом организме этот элемент играет одну из важнейших ролей: нарушение в усвоении железа или недостаточное количество последнего в рационе гарантирует в лучшем случае анемию.
Усваивается железо с большим трудом – 5–10% от всего количества, поступаемого в организм, или 10–20%, если наблюдается его недостаток.
- Обычная суточная потребность в железе составляет 10 мг для мужчин и 20 мг для женщин.
- Токсическая доза – 200 мг/сутки.
- Летальная – 7–35 г. Получить такое количество железа практически невозможно, поэтому отравление железом встречается крайне редко.
Железо – металл, чьи физические характеристики, в частности, прочность, можно существенно изменить, прибегая к механической обработке или добавке очень небольшого количества легирующих элементов. Эта особенность в сочетании с доступностью и легкостью добычи металла делает железо самым востребованным конструкционным материалом.
Еще больше о свойствах железа расскажет специалистка в видео ниже:
Источник: http://stroyres.net/metallicheskie/vidyi/chyornyie/zhelezo/fizicheskie-harakteristiki.html