Температура плавления бериллия
Бериллий
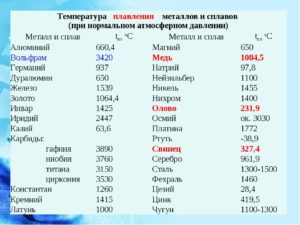
БЕРИЛЛИЙ, Be (лат. Beryllium * а. berillium; н. Beryllium; ф. beryllium; и. berilio), — химический элемент II группы периодической системы Менделеева, атомный номер 4, атомная масса 9,0122.
Имеет один стабильный изотоп 9Ве. Открыт в 1798 французским химиком Л. Вокленом в виде оксида ВеО, выделенного из берилла. Металлический бериллий независимо друг от друга получили в 1828 немецкий химик Ф.
Вёлер и французский химик А. Бюсси.
Свойства бериллия
Бериллий — лёгкий светло-серый металл. Кристаллическая структура а-Be (269-1254°С) гексагональная; Я-Be (1254-1284°С) — объёмноцентрированная, кубическая. Плотность 1844 кг/м3, t плавления 1287°С, t кипения 2507°С.
Обладает наиболее высокой из всех металлов теплоёмкостью 1,80 кДж/кг • К, высокой теплопроводностью 178 Вт/м • К при 50°С, низким удельным электрическим сопротивлением (3,6-4,5) • 10 Ом • м при 20°С; коэффициентом термического линейного расширения 10,3-13,1 • 10-6 град-1 (25- 100°С).
Бериллий — хрупкий металл; ударная вязкость 10-50 кДж/м2. Бериллий обладает малым поперечным сечением захвата тепловых нейтронов.
Химические свойства бериллия
Бериллий — типичный амфотерный элемент с высокой химической активностью; компактный бериллий устойчив на воздухе благодаря образованию плёнки ВеО; степень окисления берилля +2.
Соединения бериллия
При нагревании соединяется с кислородом, галогенами и другими неметаллами. С кислородом образует оксид ВеО, с азотом — нитрид Be3N2, с углеродом — карбид Ве2С, с серой — сульфид BeS. Растворим в щелочах (с образованием гидрооксобериллатов) и большинстве кислот.
При высоких температурах бериллий взаимодействует с большинством металлов, образуя бериллиды. Расплавленный бериллий взаимодействует с оксидами, нитридами, сульфидами, карбидами. Из соединений бериллий наибольшее промышленное значение имеют ВеО, Ве(ОН)2, фторбериллаты, например Na2BeF4 и др.
Летучие соединения бериллий и пыль, содержащая бериллий и его соединения, токсичны.
Бериллий — редкий (кларк 6•10-4%), типично литофильный элемент, характерный для кислых и щелочных пород. Из 55 собственных минералов бериллий 50% принадлежит к силикатам и бериллийсиликатам, 24% — к фосфатам, 10% — к окислам, остальные — к боратам, арсенатам, карбонатам.Близость потенциалов ионизации определяет сродство бериллия и цинка в щелочной среде, так что они одновременно находятся в некоторых гидротермальных месторождениях, а также входят в состав одного и того же минерала — гентгельвина. В нейтральных и кислых средах пути миграции бериллия и цинка резко расходятся.
Некоторое рассеивание бериллия в горных породах определяется его химическим сходством с Al и Si. Особенно близки эти элементы в виде тетраэдрических группировок ВеО46-, AlO45- и SiO44-. В гранитах проявляется большее сродство бериллия к кремнию, а в щелочных породах — к алюминию. Т. к.
энергетически более выгодно замещение Аl3+IV на Ве2+IV, чем Si4+IV на Ве2+IV, то изоморфное рассеивание бериллия в щелочных породах, как правило, выше, чем в кислых. Геохимическая миграция бериллия связана с фтором, с которым он образует весьма устойчивые комплексы BeF42-, BeF31-, BeF20, BeF1+.
При повышении температуры и щёлочности эти комплексы легко гидролизуются до соединений Be(OH)F0, Be(OH)2F1-, в виде которых бериллий мигрирует.
Об основных генетических типах месторождений бериллия и схемы обогащения см. в ст. Бериллиевые руды. В промышленности металлический бериллий получают термическим восстановлением BeF2 магнием, бериллий высокой чистоты — переплавкой в вакууме и вакуумной дистилляцией.
Применение бериллия
Бериллий и его соединения применяют в технике (свыше 70% общего потребления металла) как легирующую добавку к сплавам на основе Cu, Ni, Zn, Al, Pb и других цветных металлов. В ядерной технике Be и ВеО используют в качестве отражателей и замедлителей нейтронов, а также в качестве источника нейтронов.
Малая плотность, высокая прочность и жаростойкость, большой модуль упругости и хорошая теплопроводность позволяют применять бериллий и его сплавы как конструкционный материал в авиа-, ракетостроении и космической технике. Сплавы бериллия и оксида бериллия отвечают требованиям прочности и коррозионной устойчивости в качестве материалов для оболочек твэлов.
Бериллий служит для изготовления окон рентгеновских трубок, нанесения твёрдого диффузионного слоя на поверхность стали (бериллизация), в качестве присадок к ракетному топливу. Потребителем Be и ВеО являются также электротехника и радиоэлектроника; ВеО используют как материал корпусов, теплоотводов и изоляторов полупроводниковых приборов.
Благодаря высокой огнеупорности, инертности по отношению к большинству расплавленных металлов и солей оксид бериллий применяется для изготовления тиглей и специальной керамики.
№4 Бериллий
Бериллий был открыт в 1798 году Л. Вокленом в виде берилловой земли (оксида ВеО), когда этот французский химик выяснял общие особенности химического состава драгоценных камней берилла и изумруда. Металлический бериллий был получен в 1828 г. Ф. Велером в Германии и независимо от него А.
Бюсси во Франции. Однако из-за примесей его не удавалось сплавить. Лишь в 1898 г. французский химик П. Лебо, подвергнув электролизу двойной фторид калия и бериллия, получил достаточно чистые металлические кристаллы бериллия.
Интересно, что из-за сладкого вкуса растворимых в воде соединений бериллия элемент вначале называли «глюциний» (от греческого glykys — сладкий). Из-за сходства свойств бериллия и алюминия считалось, что это трехвалентный металл с атомной массой 13,5. Эту ошибку исправил Д.И.
Менделеев, который, исходя из закономерности изменения свойств элементов в периоде, определил бериллию место во второй группе.
Нахождение в природе, получение:
Бериллий относится к редким элементам, его содержание в земной коре 2,6·10-4% по массе. В морской воде содержится до 6·10-7 мг/л бериллия.Основные природные минералы, содержащие бериллий: берилл Be3Al2(SiO3)6, фенакит Be2SiO4, бертрандит Be4Si2O8·H2O и гельвин (Mn,Fe,Zn)4[BeSiO4]3S.
Окрашенные примесями катионов других металлов прозрачные разновидности берилла — драгоценные камни, например, зеленый изумруд, голубой аквамарин, гелиодер, воробьевит и другие. В настоящее время их научились синтезировать искусственно.
В виде простого вещества в XIX веке бериллий получали действием калия на безводный хлорид бериллия:
BeCl2+2K=Be+2KCl.
В настоящее время бериллий получают,восстанавливая его фторид магнием:
BeF2+Mg=Be+MgF2
либо электролизом расплава смеси хлоридов бериллия и натрия. Исходные соли бериллия выделяют при переработке бериллиевой руды.
Физические свойства:
Металлический бериллий — твердый, хрупкий металл серого цвета. На воздухе бериллий, как и алюминий, покрыт оксидной пленкой, придающей ему матовый цвет.
Температура плавления 1278°C, температура кипения около 2470°C, плотность 1,816 кг/м3.
До температуры 1277°C устойчив a-Ве (гексагональная решетка типа магния (Mg), параметры а = 0,22855 нм, с = 0,35833 нм), при температурах, предшествующих плавлению металла (1277-1288°C) — b-Ве с кубической решеткой.
Химические свойства:
Наличие оксидной пленки предохраняет металл от дальнейшего разрушения и обусловливает его невысокую химическую активность при комнатной температуре. При нагревании бериллий сгорает на воздухе с образованием оксида BeO, реагирует с серой и азотом. С галогенами бериллий реагирует при обычной температуре или при слабом нагревании.
Все эти реакции сопровождаются выделением большого количества теплоты, так как прочность кристаллических решеток возникающих соединений (BeO, BeS, Be3N2, ВеCl2 и др.) довольно велика. Благодаря образованию на поверхности прочной пленки бериллий не реагирует с водой, хотя находится в ряду стандартных потенциалов значительно левее водорода.
Как и алюминий, бериллий реагирует с кислотами и растворами щелочей:
Be + 2HCl = BeCl2 + H2,
Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2. Интересно, что бериллий хорошо растворяется в концентрированных растворах фторидов:
Be + 4NH4F + 2H2O = (NH4)2[BeF4] + 2NH3*H2O + H2↑
Причина — образование прочных фторидных комплексов.
Важнейшие соединения:
Оксид бериллия, BeO встречается в природе в виде редкого минерала бромеллита. Получают термическим разложением сульфата или гидроксида бериллия выше 800° С. Продукт высокой чистоты образуется при разложении основного ацетата [Be4O(OOCH3)6] выше 600°С.
Непрокаленный оксид бериллия гигроскопичен, адсорбирует до 34% воды, а прокаленный при 1500° С — лишь 0,18%. Оксид бериллия, прокаленный не выше 500°С, легко взаимодействует с кислотами, труднее — с растворами щелочей, а прокаленный выше 727° С — лишь со фтороводородной кислотой, горячей концентрированной серной кислотой и расплавами щелочей.
Устойчив к воздействию расплавленных лития, натрия, калия, никеля и железа. Оксид бериллия обладает очень высокой теплопроводностью. Считается одним из лучших огнеупорных материалов, используется для изготовления тиглей и других изделий
Гидроксид бериллия, Be(OH)2 — полимерное соединение, нерастворимое в воде.
Оно проявляет амфотерные свойства: Be(OH)2 + 2КOH = К2[Be(OH)4], Be(OH)2 + 2HCl = BeCl2 + 2H2O.
Действием на гидроксид бериллия Be(OH)2 растворами карбоновых кислот или при упаривании растворов их бериллиевых солей получают оксисоли бериллия, например, оксиацетат Be4O(CH3COO)6.
Галогениды бериллия, бесцв. крист. вещества, расплываются на воздухе, поглощая влагу. Для получения безводного хлорида используется реакция 2BeO + CCl4 = 2BeCl2 + CO2
Подобно хлориду алюминия BeCl2 является катализатором в реакции Фриделя – Крафтса. В растворах подвергается гидролизу…
Бериллаты, в концентрированных растворах и расплавах щелочей присутствуют бериллаты состава M2BeO2, M3BeO4, в разбавленных растворах гидроксобериллаты M2[Be(OH)4]. Легко гидролизуются до гидроксида бериллия.
…
Гидрид бериллия, BeH2 — полимерное вещество, его получают реакцией:BeCl2 + 2LiH = BeH2 + 2LiCl
Карбид бериллия, Be2С — образуется при взаимодействии бериллия с углеродом. Подобно карбиду алюминия гидролизуется водой с образованием метана.
Применение:
Бериллий в основном используют как легирующую добавку к различным сплавам. Добавка бериллия значительно повышает твердость и прочность сплавов, коррозионную устойчивость поверхностей изготовленных из этих сплавов изделий.
Бериллиевые бронзы (Cu и 3-6% Be) – материал для пружин c большой устойчивостью к механической усталости и совершенно не дающих искр при механических ударах.
Бериллий слабо поглощает рентгеновское излучение, поэтому из него изготавливают окошки рентгеновских трубок (через которые излучение выходит наружу). В атомных реакторах из бериллия изготовляют отражатели нейтронов, его используют как замедлитель нейтронов.
В смесях с некоторыми a-радиоактивными нуклидами бериллий используют в ампульных нейтронных источниках, так как при взаимодействии ядер бериллия-9 и a-частиц возникают нейтроны: 9Ве(a,n)12C.
Физиологическое действие: в живых организмах бериллий, по-видимому, не несет никакой биологической функции, однако бериллий может замещать магний в некоторых ферментах, что приводит к нарушению их работы. Летучие и растворимые соединения бериллия, а также пыль, содержащая бериллий и его соединения, очень токсичны, канцерогенны (ПДК 0,001 мг/м3).
Рудакова Анна Валерьевна
ХФ ТюмГУ, 561 группа.
История
Воклен, Луи Никола
Открыт в 1798г. французским химиком Луи Никола Вокленом. Большую работу по установлению состава соединений бериллия и его минералов провёл русский химик И.В.Авдеев (1818—1865). Именно он доказал, что оксид бериллия имеет состав BeO, а не Be2O3, как считалось ранее.
Происхождение названия
Схема строения атома бериллия
Определение элемента бериллий произошло от названия минерала берилла (beryllos) (силикат бериллия и алюминия, Be3Al2Si6O18), которое восходит к названию города Белур (Веллуру) в Южной Индии, недалеко от Мадраса; с древних времён в Индии были известны месторождения изумрудов— разновидности берилла. Из-за сладкого вкуса растворимых в воде соединений бериллия элемент вначале называли «глюциний» (от греч. glykys— сладкий).
Нахождение в природе
Изотоп 8Be отсутствует в природе, поскольку является крайне нестабильным и имеет период полураспада 10−18 с. Стабильным является 9Be. Кроме 9Be в природе встречаются радиоактивные изотопы 7Be и 10Be.
бериллия в земной коре— около 3,5 г/т, обычно он встречается как примесь к различным минералам.
Известно более 30 собственно бериллиевых минералов, но только 6 из них считаются более-менее распространёнными: берилл, хризоберилл, бертрандит, фенакит, гельвин, даналит.Промышленное значение имеет в основном берилл, в РФ (Республика Бурятия) разрабатывается фенакит-бертрандитовое Ермаковское месторождение.
Разновидности берилла считаются драгоценными камнями: аквамарин — голубой, зеленовато-голубой, голубовато-зеленый; изумруд— густо-зеленый, ярко-зеленый; гелиодор — желтый; известны ряд других разновидностей берилла, различающихся окраской (темно-синие, розовые, красные, бледно-голубые, бесцветные и др.). Цвет бериллу придают примеси различных элементов.
Физические свойства
Бериллий— мягкий, но не пластичный (легко разрушается) металл серебристо-белого цвета. Имеет высокий (в связи с чем ему ошибочно приписывается высокая твёрдость) модуль упругости— 300 ГПа (у сталей— 200—210 ГПа). На воздухе активно покрывается стойкой оксидной плёнкой BeO.
Модуль продольной упругости (модуль Юнга) 300 ГПа (312кгс/мм2). Механические свойства Бериллия зависят от чистоты металла, величины зерна и текстуры, определяемой характером обработки.
Предел прочности Бериллия при растяжении 200—550 Мн/м2(20-55 кгс/мм2), удлинение 0,2-2%, что при таком высоком модуле упругости обеспечивает его хрупкость. Обработка давлением приводит к определенной ориентации кристаллов.
Возникает анизотропия, становится возможным значительное улучшение свойств. Предел прочности в направлении вытяжки доходит до 400—800 Мн/м2(40-80 кгс/мм2), предел текучести 250—600 Мн/м2(25-60 кгс/мм2), а относительное удлинение до 4-12%.
Механические свойства в направлении, перпендикулярном вытяжке, почти не меняются. Бериллий— хрупкий металл; его ударная вязкость 10-50 кДж/м2 (0,1-0,5 кгс·м/см2). Температура перехода Бериллия из хрупкого состояния в пластическое 200—400°C.
Получение
В виде простого вещества в XIX веке бериллий получали действием калия на безводный хлорид бериллия:
В настоящее время бериллий получают, восстанавливая его фторид магнием:
,
либо электролизом расплава смеси хлоридов бериллия и натрия. Исходные соли бериллия выделяют при переработке бериллиевой руды.
Легирование сплавов
Бериллий в основном используют как легирующую добавку к различным сплавам.
Добавка бериллия значительно повышает твёрдость и прочность сплавов, коррозионную устойчивость поверхностей изготовленных из этих сплавов изделий.
В технике довольно широко распространены бериллиевые бронзы типа BeB (пружинные контакты). Добавка 0,5% бериллия в сталь позволяет изготовить пружины, которые пружинят при красном калении.
Рентгенотехника
Бериллий слабо поглощает рентгеновское излучение, поэтому из него изготавливают окошки рентгеновских трубок (через которые излучение выходит наружу).
Ядерная энергетика
В атомных реакторах из бериллия изготовляют отражатели нейтронов, его используют как замедлитель нейтронов.
В смесях с некоторыми α-радиоактивными нуклидами бериллий используют в ампульных нейтронных источниках, так как при взаимодействии ядер бериллия-9 и α-частиц возникают нейтроны: 9Ве + α → n + 12C.
Оксид бериллия является наиболее теплопроводным из всех оксидов и служит высокотеплопроводным высокотемпературным изолятором, и огнеупорным материалом(тигли), а кроме того наряду с металлическим бериллием служит в атомной технике как более эффективный замедлитель и отражатель нейтронов чем чистый бериллий, кроме того оксид бериллия в смеси с окисью урана применяется в качестве очень эффективного ядерного топлива. Фторид бериллия в сплаве с фторидом лития применяется в качестве теплоносителя и растворителя солей урана, плутония, тория в высокотемпературных жидкосолевых атомных реакторах.
Фторид бериллия используется в атомной технике для варки стекла применяемого для регулирования небольших потоков нейтронов. Самый технологичный и качественный состав такого стекла -(BeF2−60%,PuF4−4%,AlF3−10%, MgF2−10%, CaF2−16%). Этот состав наглядно показывает один из примеров применения соединений плутония в качестве конструкционного материала (частичное).
Лазерные материалы
В лазерной технике находит применение алюминат бериллия для изготовления твердотельных излучателей (стержней, пластин).
Аэрокосмическая техника
В производстве тормозов для аэрокосмической техники, тепловых экранов и систем наведения с бериллием не может конкурировать практически ни один конструкционный материал.
Конструкционные материалы на основе бериллия обладают одновременно и лёгкостью, и прочностью, и стойкостью к высоким температурам. Будучи в 1,5 раз легче алюминия, эти сплавы в то же время прочнее многих специальных сталей.
Налажено производство бериллидов применяемых как конструкционные материалы для двигателей и обшивки ракет и самолетов, а так же в атомной технике.
Ракетное топливо
Стоит отметить высокую токсичность и высокую стоимость металлического бериллия, и в этой связи приложены значительные усилия для выявления бериллийсодержащих топлив имеющих значительно меньшую общую токсичность и стоимость. Одним из таких соединений бериллия является гидрид бериллия.
Огнеупорные материалы
Оксид бериллия 99,9%(изделие)
Оксид бериллия применяется в качестве очень важного огнеупорного материала в специальных случаях. Считается одним из лучших огнеупорных материалов и при этом это самый теплопроводный огнеупорный материал.
Биологическая роль и физиологическое действие
В живых организмах бериллий не несёт какой-либо значимой биологической функции. Однако бериллий может замещать магний в некоторых ферментах, что приводит к нарушению их работы. Нормальное содержание бериллия в организме взрослого человека (при массе тела 60 кг) составляет 0,031мг, ежедневное поступление с пищей— около 0,01мг.
Бериллий— ядовит: Летучие (и растворимые) соединения бериллия, в том числе и пыль, содержащая соединения бериллия, высокотоксичны.
Для воздуха ПДК (предельно допустимые концентрации) вещества в пересчёте на бериллий составляет 0,001 мг/м³. Бериллий обладает ярко выраженным аллергическим и канцерогенным действием.
Вдыхание атмосферного воздуха содержащего бериллий приводит к тяжёлому заболеванию органов дыхания — бериллиозу.
Дополнительная информация по Бериллию
Соединения бериллия
Бериллий, Beryllium, Be (4)
Содержащие бериллий минералы (драгоценные камни) — берилл, смарагд, изумруд, аквамарин и др.- известны с глубокой древности. Некоторые из них добывались на Синайском полуострове еще в XVII в. до н. э. В Стокгольмском папирусе (III в.) описываются способы изготовления поддельных камней.
Название берилл встречается у греческих и латинских (Beryll) античных писателей и в древнерусских произведениях, например в «Изборнике Святослава» 1073 г., где берилл фигурирует под названием вируллион. Исследование химического состава драгоценных минералов этой группы началось, однако, лишь в конце XVIII в.
с наступлением химико-аналитического периода.
Первые анализы (Клапрот, Биндгейм и др.) не обнаружили в берилле ничего особенного.
В конце XVIII в. известный минералог аббат Гаюи обратил внимание на полное сходство кристаллического строения берилла из Лиможа и смарагда из Перу. Вокелен произвел химический анализ обоих минералов (1797) и обнаружил в обоих новую землю, отличную от алюмины.
Получив соли новой земли, он установил, что некоторые из них обладают сладким вкусом, почему и назвал новую землю глюцина (Glucina) от греческого — сладкий. Новый элемент, содержащийся в этой земле, был назван соответственно глюцинием (Glucinium). Это название употреблялось во Франции в XIX в.
, существовал даже символ — Gl.
Клапрот, будучи противником наменования новых элементов по случайным свойствам их соединений, предложил именовать глюциний бериллием (Beryllium), указав, что сладким вкусом обладают соединения и других элементов. Металлический бериллий был впервые получен Велером и Бусси в 1728 г. путем восстановления хлорида бериллия металлическим калием.Отметим здесь выдающиеся исследования русского химика И.В.Авдеева по атомному весу и составу окисла бериллия (1842). Авдеев установил атомный вес бериллия 9,26 (совр.9,0122), тогда как Берцелиус принимал его равным 13,5, и правильную формулу окисла.
О происхождении названия минерала берилл, от которого образовано слово бериллий, существует несколько версий. А. М. Васильев (по Диргарту) приводит следующее мнение филологов: латинское и греческое названия берилла могут быть сопоставлены с практритским veluriya и санскритским vaidurya.
Последнее является названием некоторого камня и происходит от слова vidura (очень далеко), что, по-видимому, означает какую-то страну или гору. Мюллер предложил другое объяснение: Vaidurya произошло от первоначального vaidarya или vaidalya, а последнее от vidala (кошка). Иначе говоря, vaidurya означает приблизительно «кошачий глаз».
Рай указывает, что в санскрите топаз, сапфир и коралл считались кошачьим глазом. Третье объяснение дает Липпман, который считает, что слово берилл обозначало какую-то северную страну (откуда поступали драгоценные камни) или народ.
В другом месте Липпман отмечает, что Николай Кузанский писал, что немецкое Brille (очки) происходит от варварско-латинского berillus. Наконец, Лемери, объясняя слово берилл (Beryllus), указывает, что Berillus, или Verillus, означает «мужской камень».
В русской химической литературе начала XIX в.
глюцина называлась — сладимая земля, сладозем (Севергин, 1815), сладкозем (Захаров, 1810), глуцина, глицина, основание глицинной земли, а элемент именовался глицинием, глицинитом, глицием, сладимцем и пр. Гизе предложил название бериллий (1814). Гесс, однако,придерживался названия глиций; его употреблял в качестве синонима и Менделеев (1-е изд. «Основ химии»).
Бериллий: это что, и где его используют?
Бериллий – это элемент второй группы 2-го периода таблицы Менделеева, имеющий атомный номер 4 и обозначающийся символом Ве. Он высокотоксичный и обладает множеством специфических свойств, которые обусловили его широкое применение во многих сферах. И сейчас будет рассказано как о характеристиках данного элемента, так и об его использовании.
Химические особенности
Данный металл по целому ряду своих свойств похож на алюминий – это прослеживается даже в уравнениях реакций бериллия, которые, кстати, весьма специфичны. При комнатной температуре металл имеет низкую реакционную способность, а в компактном виде не взаимодействует даже с водой и паром.
Воздухом он окисляется до температуры 600 °C. Когда данный показатель превышается, то становятся возможными реакции с галогенами. А вот для взаимодействия с халькогенами необходимы еще более высокие температуры.
С аммиаком, например, бериллий может вступить в реакцию, только если будет более 1200 °C. Вследствие этого образуется нитрид Be3N2. Но зато порошок данного вещества горит впечатляющим ярким пламенем.
И при этом образуется нитрид и оксид.
Be(OH)2
Это гидроксид бериллия. При нормальных условиях он выглядит как гелеобразное вещество белого цвета, которое почти не растворяется в воде. Но зато этот процесс успешно происходит, когда он попадает в разбавленную минеральную кислоту.
Вот так, кстати, выглядит реакция серной кислоты и гидроксида бериллия по формуле: Ве(ОН)2 + H2SO4 → BeSO4 + 2Н2О. В результате, как можно видеть, образуется соль и вода. С щелочами оксид тоже взаимодействует.
Выглядит это так: Ве(ОН)2 + 2NaOH → Na2Be(OH)4.
Еще интересная реакция происходит при температурном воздействии. Если увеличить показатель до 140 °C, то вещество разложится на оксид и воду: Ве(ОН)2 → ВеО + Н2О. Кстати, получают гидроксид посредством обработки солей бериллия, которая происходит либо с участием щелочных металлов, либо в ходе гидролиза натрия. Также в данном процессе может участвовать фосфид металла.
BeSO4
Это сульфат бериллия. Это вещество представляет собой твердые кристаллы белого цвета. Его получают в результате взаимодействия серной кислоты и любой соли бериллия в воде. Сопровождается процесс выпариванием и последующей кристаллизацией получающегося в итоге продукта.
Если нагреть гидрат до 400 °C, то получится разложить его на Н2О и безводную соль. У BeSO4 было весьма специфичное применение. Его смешивали с сульфатом радия (неорганическое вещество щелочноземельного радиоактивного металла) и использовали в атомных реакторах в качестве источника нейтронов.
На сегодняшний день его нередко применяют в таком виде альтернативной медицины, как гомеопатия.
Ве(NO3)2
Это нитрат бериллия. Он является средней солью этого металла и азотной кислоты. Данное соединение может существовать лишь как кристаллогидраты различного состава. Безводных нитратов просто не существует.
Вследствие добавления концентрированной азотной кислоты удается выделить из водного раствора тетрагидрат бериллия. Формула выглядит так: Ве(NO3)2•4Н2О. Интересно, что кристаллы данного вещества расплываются на воздухе.
А в результате реакций, проводимых в растворе с 54-процентным содержанием азотной кислоты, может образовываться тригидрат. Также с участием данных веществ можно образовать дигидрат.
Нитрат данного металла раньше активно использовался в производстве колпачков так называемых газокалильных ламп. Он идеально для этого подходил, ведь мог термически разлагаться, образовывая оксид.
Но потом повсеместно начало распространяться электрическое освещение, и данная технология канула в лету, как и применение нитрата. Он, к слову, является токсичным, как и любые другие бериллиевые соединения.
Более того, даже в малых количествах данное вещество – раздражитель, провоцирующий острую пневмонию.
Получение металла
В промышленности бериллий – это активно используемый металл, который нужно производить в большом количестве. Поэтому используется самый оперативный метод. Заключается он в переработке берилла (минерала, кольцевого силиката) в сульфат или гидроксид данного элемента.
Металлический бериллий производят посредством восстановления фторида BeF2 при помощи магния. Осуществляется данный процесс при температурном режиме в 900-1300 °С или другим методом – электролизом хлорида BeCl2.
В этой реакции участвует хлорид натрия (NaCl), а происходит все при температуре 350 °С.Получаемое в итоге вещество отправляют на дистилляцию в вакуум. Результатом данного процесса становится металл высокой чистоты.
Металлопроизводство
В этой сфере активно применяется такой химический элемент, как бериллий. Он – эффективная легирующая добавка. Бериллий включают в состав сплавов для того, чтобы повысить их прочности и твердость. С присутствием данного металла они также обретают коррозионную устойчивость.
Изделия, произведенные из сплавов с бериллием, очень долговечные и прочные. Какие, например? Яркий пример – пружинные контакты. Всего 0,5 % этого металла достаточно добавить в бронзу, из которой их делают. Пружины получаются крепкими и остаются упругими вплоть до температуры красного каления.
Они, в отличие от изделий из любого другого сплава, выдерживают миллиарды циклов огромной нагрузки.
В производстве систем наведения и тепловых экранов ни один другой конструкционный металл не проявляет себя так, как бериллий. Ему в данной сфере нет равных. Этот металл добавляют в конструкционные материалы, чтобы они обрели легкость и при этом получили увеличенную стойкость к высоким температурам и прочность. Такие сплавы получаются в полтора раза легче алюминия и прочнее.
Еще в строении аэрокосмической техники используются бериллиды, являющиеся интерметаллическими соединениями данного вещества с другими металлами. Они очень твердые, имеют малую удельную плотность и поразительную устойчивость к температуре.
Поэтому из бериллидов делают обшивки самолетов и ракет, используют их в производстве двигателей, систем наведения, тормозов. Даже сплавы титана по своим качествам проигрывают данным веществам. Кстати, немалому количеству бериллидов свойственны специфические ядерные характеристики.
Именно поэтому их еще применяют в атомной энергетике (делают отражатели нейтронов, например).
Другие сферы применения
Помимо перечисленного, бериллий (точнее его алюминат) также используют в производстве твердотельных излучателей. Были выявлены и топлива, содержащие это вещество. Они являются менее токсичными и более дешевыми, чем все остальные.
В частности, было обнаружено ракетное топливо с гидридом бериллия. Важно отметить, что уже упомянутый ранее оксид бериллия – самый теплопроводный из всех существующих.
Поэтому его используют в качестве высокотемпературного изолятора и стойкого огнеупорного материала.
А еще бериллий является популярным веществом для изготовления электродинамических громкоговорителей. Ведь он твердый и легкий.Вот только из-за хрупкости, дорогостоящей обработки и токсичности динамики с этим металлом применяют лишь в профессиональных аудиосистемах.
А некоторые производители, чтобы улучшить показатели своих продаж, заявляют об использовании этого металла в своей технике, даже если это не так.
Бериллий — свойства, применения сплавы бериллия
История открытия бериллия начинается с XVIII столетия, в конце которого французский химик Л. Воклен пытался установить, чем схож по химическому составу ценный минерал бериллия с изумрудом. Из последнего минерала он и выделил оксид элемента BeO. Получить металлический бериллий удалось лишь 30 лет спустя в 1828 году.
Пройдет еще семидесятилетие, прежде чем другой француз – Поль Лебо синтезирует чистые металлические кристаллы вещества посредством электролиза бериллия и двойного фторида калия. Ученый пошел далее, испытав кристаллический порошок на вкус, откуда и пошло изначальное название элемента – глюциний (glykуs – сладкий в переводе с греческого).
Кстати, во Франции наименование бериллий – Be часто сопровождается Glicinium – Gl до сих пор.
Физические свойства бериллия
В свободном состоянии элемент представляет легкий металл серебристо-серого цвета. На воздухе бериллий приобретает матовый оттенок вследствие, быстрого образования поверхностной оксидной пленки.
Строение атома бериллия включает четыре электрона, образующих конфигурацию 1s22s2. Параметры атомного и ионного радиусов Ве составляют 0.113, 0.034 нанометра, соответственно. Порядковый номер элемента в периодической таблице – 4.
Атомная масса бериллия – 9.0122.
Фото бериллий
Элемент характеризуется плотностью 1.816 грамм на сантиметр кубический, и рядом критических температур:
- фазового перехода от гексагональной к кубической решетке – 1277 0С.
Бериллий характеризуется наивысшей теплоемкостью, относительно других металлов, хорошей теплопроводностью и низким электрическим сопротивлением.
Получение бериллия
Металлический Be получают из одноименного минерала – берилл. Для этого, исходное сырье перерабатывается в гидроксид или сульфат бериллия. В обоих случаях процедура проходит в несколько стадий.
В частности, чтобы получить сульфат бериллия, исходный минерал спекается с известью. Полученное соединение впоследствии обрабатывается серной кислотой.
На заключительной стадии образовавшийся сульфат бериллия выщелачивают водой и осаждают аммиаком.
— Дороже Золота. Первый российский бериллий:
Альтернативные способы получения чистой формы металла, предусматривают вскрытие берилла, с последующей обработкой состава двумя способами, чтобы получить:
- Фторид бериллия.
- Хлорид бериллия.
В первом случае, полученный фторид бериллия проходит процедуру восстановления магнием при температуре около 1000 0С. Во втором варианте, для выделения чистого металла производится электролиз хлорида бериллия в смеси с NaCl.
Завершающий этап – получение высокочистого металлического Be происходит различными способами:
- электронное рафинирование.
Полученный металл измельчают до порошкообразного состояния и прессуют в вакууме при температуре около 1150 0С.
Трубная продукция, прутки и прочие виды профилей металла изготавливаются по технологии горячего и теплого выдавливания, тогда как листовой бериллий производится посредством прокатки. Ковки или волочения.
Биологическое воздействие бериллия
Как элемент, Be присутствует в тканях большинства представителей флоры и фауны. Так, концентрация бериллия в почве составляет тысячные доли процента, для золы растений эта величина на порядок меньше.
Относительно животных, Be равномерно распределен у них по тканям, с суммарной концентрацией, которая исчисляется в пределах от десятитысячных до тысячных долей процента. При нормально функционировании организма, половина бериллия выделяется с мочой.
Оставшаяся часть элемента оседает в костях – 30%, печени и почках – по 8%.
Металлическая пыль бериллия — очень опасна для человека
Опасен ли бериллий?
Для человека вредны летучие соединения бериллия, его пыль. Как результат, переработка Be требует соблюдения определенных норм безопасности, в частности использование специальных мер защиты, чтобы избежать отравления бериллием.
Случай в истории СССР
В недалекие советские времена, а именно в 1990 году, в Казахской ССР на одном из металлургических предприятий (сейчас это АО УМЗ), которое работало с бериллием, произошел взрыв в бериллиевом цехе — вся опасная пыль и мелкая стружка поднялась в небо над городом Усть-Каменогорск. Превышение ПДК вредных веществ, как тогда зафиксировали, составило 14 000 раз.
Всего произошло около 5 взрывов, при этом в воздух поднялось 65 тонн мельчайшего бериллия. Как это все происходило и как боролись с катастрофой — читайте историю большого взрыва.
После взрыва люди боялись последствий, кто-то пророчил, что результат взрыва проявится через 15 лет — на нынешних детях, на беременных женщинах, какие именно тяжелые последствия ждут людей — никто толком не знал.
И вот, прошло уже больше 26 лет — катастрофических изменений в жизни населения города не произошло, не считаю тех людей, кто оказался непосредственно в эпицентре взрыва, городу повезло — пыль осела и не распространилась воздуху.Так сегодня выглядит территория завода АО «УМЗ» в котором и сейчас существует бериллиевый цех