Активные металлы список в химии
Общие физические и химические свойства металлов

Благодаря наличию свободных электронов (“электронного газа”) в кристаллической решетке все металлы проявляют следующие характерные общие свойства:
1) Пластичность – способность легко менять форму, вытягиваться в проволоку, прокатываться в тонкие листы.
2) Металлический блеск и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл светом.
3) Электропроводность. Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение “электронного газа”.
4) Теплопроводность. Обусловлена высокой подвижностью свободных электронов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность – у висмута и ртути.
5) Твердость. Самый твердый – хром (режет стекло); самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом.
6) Плотность. Она тем меньше, чем меньше атомная масса металла и больше радиус атома. Самый легкий – литий (ρ=0,53 г/см3); самый тяжелый – осмий (ρ=22,6 г/см3). Металлы, имеющие плотность менее 5 г/см3 считаются “легкими металлами”.7) Температуры плавления и кипения. Самый легкоплавкий металл – ртуть (т.пл. = -39°C), самый тугоплавкий металл – вольфрам (t°пл. = 3390°C). Металлы с t°пл. выше 1000°C считаются тугоплавкими, ниже – низкоплавкими.
Общие химические свойства металлов
Сильные восстановители: Me0 – nē → Men+
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительных реакциях в водных растворах.
1. Реакции металлов с неметаллами
1) С кислородом:
2Mg + O2 → 2MgO
2) С серой:
Hg + S → HgS
3) С галогенами:
Ni + Cl2 –t°→ NiCl2
4) С азотом:
3Ca + N2 –t°→ Ca3N2
5) С фосфором:
3Ca + 2P –t°→ Ca3P2
6) С водородом (реагируют только щелочные и щелочноземельные металлы):
2Li + H2 → 2LiH
Ca + H2 → CaH2
2. Реакции металлов с кислотами
1) Металлы, стоящие в электрохимическом ряду напряжений до H восстанавливают кислоты-неокислители до водорода:
Mg + 2HCl → MgCl2 + H2
2Al+ 6HCl → 2AlCl3 + 3H2
6Na + 2H3PO4 → 2Na3PO4 + 3H2
2) С кислотами-окислителями:
При взаимодействии азотной кислоты любой концентрации и концентрированной серной с металлами водород никогда не выделяется!
Zn + 2H2SO4(К) → ZnSO4 + SO2 + 2H2O
4Zn + 5H2SO4(К) → 4ZnSO4 + H2S + 4H2O
3Zn + 4H2SO4(К) → 3ZnSO4 + S + 4H2O
2H2SO4(к) + Сu → Сu SO4 + SO2 + 2H2O
10HNO3 + 4Mg → 4Mg(NO3)2 + NH4NO3 + 3H2O
4HNO3(к) + Сu → Сu (NO3)2 + 2NO2 + 2H2O
3. Взаимодействие металлов с водой
1) Активные (щелочные и щелочноземельные металлы) образуют растворимое основание (щелочь) и водород:
2Na + 2H2O → 2NaOH + H2
Ca+ 2H2O → Ca(OH)2 + H2
2) Металлы средней активности окисляются водой при нагревании до оксида:
Zn + H2O –t°→ ZnO + H2
3) Неактивные (Au, Ag, Pt) – не реагируют.
4. Вытеснение более активными металлами менее активных металлов из растворов их солей:
Cu + HgCl2 → Hg+ CuCl2
Fe+ CuSO4 → Cu+ FeSO4
В промышленности часто используют не чистые металлы, а их смеси — сплавы, в которых полезные свойства одного металла дополняются полезными свойствами другого. Так, медь обладает невысокой твердостью и малопригодна для изготовления деталей машин, сплавы же меди с цинком (латунь) являются уже достаточно твердыми и широко используются в машиностроении.
Алюминий обладает высокой пластичностью и достаточной легкостью (малой плотностью), но слишком мягок. На его основе готовят сплав с магнием, медью и марганцем – дуралюмин (дюраль), который, не теряя полезных свойств алюминия, приобретает высокую твердость и становится пригодным в авиастроении.
Сплавы железа с углеродом (и добавками других металлов) – это широко известные чугун и сталь.
Металлы в свободном виде являются восстановителями. Однако реакционная способность некоторых металлов невелика из-за того, что они покрыты поверхностной оксидной пленкой, в разной степени устойчивой к действию таких химических реактивов, как вода, растворы кислот и щелочей.
Например, свинец всегда покрыт оксидной пленкой, для его перехода в раствор требуется не только воздействие реактива (например, разбавленной азотной кислоты), но и нагревание.
Оксидная пленка на алюминии препятствует его реакции с водой, но под действием кислот и щелочей разрушается.
Рыхлая оксидная пленка (ржавчина), образующаяся на поверхности железа во влажном воздухе, не мешает дальнейшему окислению железа.
Под действием концентрированных кислот на металлах образуется устойчивая оксидная пленка. Это явление называется пассивацией. Так, в концентрированной серной кислоте пассивируются (и после этого не реагируют с кислотой) такие металлы, как Ве, Вi, Со, Fе, Мg и Nb, а в концентрированной азотной кислоте – металлы А1, Ве, Вi, Со, Сг, Fе, Nb, Ni, РЬ, Тh и U.
При взаимодействии с окислителями в кислых растворах большинство металлов переходит в катионы, заряд которых определяется устойчивой степенью окисления данного элемента в соединениях (Nа+, Са2+,А13+,Fе2+ и Fе3+)
Восстановительная активность металлов в кислом растворе передается рядом напряжений. Большинство металлов переводится в раствор соляной и разбавленной серной кислотами, но Сu, Аg и Нg – только серной (концентрированной) и азотной кислотами, а Рt и Аи – «царской водкой».
Коррозия металлов
Нежелательным химическим свойством металлов является их коррозия, т. е. активное разрушение (окисление) при контакте с водой и под воздействием растворенного в ней кислорода (кислородная коррозия). Например, широко известна коррозия железных изделий в воде, в результате чего образуется ржавчина, и изделия рассыпаются в порошок.
Коррозия металлов протекает в воде также из-за присутствия растворенных газов СО2 и SО2; создается кислотная среда, и катионы Н+ вытесняются активными металлами в виде водорода Н2 (водородная коррозия).
Особенно коррозионно-опасным может быть место контакта двух разнородных металлов (контактная коррозия).
Между одним металлом, например Fе, и другим металлом, например Sn или Сu, помещенными в воду, возникает гальваническая пара.
Поток электронов идет от более активного металла, стоящего левее в ряду напряжений (Ре), к менее активному металлу (Sn, Сu), и более активный металл разрушается (корродирует).Именно из-за этого ржавеет луженая поверхность консервных банок (железо, покрытое оловом) при хранении во влажной атмосфере и небрежном обращении с ними (железо быстро разрушается после появления хотя бы небольшой царапины, допускающей контакт железа с влагой). Напротив, оцинкованная поверхность железного ведра долго не ржавеет, поскольку даже при наличии царапин корродирует не железо, а цинк (более активный металл, чем железо).
Сопротивление коррозии для данного металла усиливается при его покрытии более активным металлом или при их сплавлении; так, покрытие железа хромом или изготовление сплава железа с хромом устраняет коррозию железа. Хромированное железо и сталь, содержащая хром (нержавеющая сталь), имеют высокую коррозионную стойкость.
Сильные металлы список
Посмотрите вокруг на секунду… Сколько металлических вещей вы можете увидеть? Обычно, когда мы думаем о металлах, мы вспоминаем о веществах, которые являются блестящими и прочными. Однако они также находятся в нашей пище и в наших телах. Давайте познакомимся с полным списком металлов, известных науке, узнаем их основные свойства и выясним, почему они такие особенные.
Что такое металлы?
Элементы, легко теряющие электроны, которые являются блестящими (отражающими), податливыми (могут быть отлиты в другие формы) и считаются хорошими проводниками тепла и электричества, называют металлами.
Они имеют решающее значение для нашего образа жизни, так как не только являются частью структур и технологий, но и важны для производства почти всех предметов. Металл есть даже в человеческом теле.
Взглянув на этикетку состава мультивитаминов, вы увидите десятки перечисленных соединений.
Возможно, вы не знали, что такие элементы, как натрий, кальций, магний и цинк, необходимы для жизни, и, если они отсутствуют в наших телах, наше здоровье может быть в серьезной опасности.
Например, кальций необходим для здоровых костей, магний — для метаболизма. Цинк усиливает функцию иммунной системы, а железо помогает клеткам крови переносить кислород по всему телу.
Однако металлы в наших телах отличаются от металла в ложке или стальном мосте тем, что они потеряли электроны. Они называются катионами.
Металлы также обладают антибиотическими свойствами, поэтому перила и ручки в общественных местах часто изготавливаются из этих элементов. Известно, что многие инструменты делаются из серебра для предотвращения размножения бактерий. Искусственные суставы изготавливаются из титановых сплавов, которые одновременно предотвращают заражение и делают реципиентов сильнее.
Все элементы в периодической системе Дмитрия Менделеева делятся на две большие группы: металлы и неметаллы. Первая является самой многочисленной. Большинство элементов — металлы (синий). Неметаллы в таблице изображены на желтом фоне.
Есть также группа элементов, которые относят к металлоидам (красный). Все металлы сгруппированы в левой части таблицы. Обратите внимание, что водород сгруппирован с металлами в верхнем левом углу. Несмотря на это, он считается неметаллическим.Однако некоторые ученые теоретизируют, что в ядре планеты Юпитер может быть металлический водород.
Металлическое связывание
Многие из замечательных и полезных качеств элемента связаны с тем, как его атомы соединяются друг с другом. При этом возникают определенные связи. Металлическое взаимодействие атомов приводит к созданию металлических структур. Любой образец этого элемента в повседневной жизни, от автомобиля до монет в кармане, включает в себя металлическое соединение.
Во время этого процесса атомы металла разделяют свои внешние электроны равномерно друг с другом. Электроны, протекающие между положительно заряженными ионами, легко передают тепло и электроэнергию, делая эти элементы такими хорошими проводниками тепла и электричества. Медные провода используются для электроснабжения.
Реакции металлов
Реакционная способность относится к тенденции элемента реагировать с химическими веществами в его окружении. Она бывает разная.
Некоторые металлы, например, калий и натрий (в колонках 1 и 2 в периодической таблице), легко реагируют со многими различными химическими веществами и редко встречаются в своей чистой, элементарной форме.
Оба обычно существуют только в соединениях (связанных с одним или несколькими другими элементами) или как ионы (заряженная версия их элементарной формы).
С другой стороны, существуют и другие металлы, их еще называют ювелирными. Золото, серебро и платина являются не очень реактивными и обычно встречаются в чистом виде. Эти металлы легче теряют электроны, чем неметаллы, но не так легко, как реактивные металлы, например, натрий. Платина относительно нереакционноспособна и очень устойчива к реакциям с кислородом.
Свойства элементов
Когда вы изучали алфавит в начальной школе, вы обнаружили, что все буквы имеют свой собственный уникальный набор свойств. Например, у некоторых были прямые линии, у некоторых — кривые, а у других были линии обоих типов. То же самое можно сказать и об элементах.
Каждый из них имеет уникальный набор физических и химических свойств. Физические свойства — это качества, присущие определенным веществам. Блестящий или нет, насколько он хорошо проводит тепло и электричество, при какой температуре тает, насколько большую имеет плотность.
Химические свойства включают те качества, которые наблюдаются при реагировании на воздействие кислородом, если они будут гореть (то, насколько сложно им будет удерживать их электроны во время химической реакции). Различные элементы могут иметь общие свойства.
Вот почему статуя Свободы зеленая, а не ржавая. Она сделана из меди, а не железа).
Организация элементов: металлы и неметаллы
Тот факт, что элементы имеют некоторые общие и уникальные свойства, позволяет сортировать их в красивую, аккуратную диаграмму, которая называется периодической таблицей. Она организует элементы на основе их атомного числа и свойств.
Итак, в периодической таблице мы находим элементы, сгруппированные вместе, которые имеют общие свойства. Железо и медь находятся близко друг к другу, оба являются металлами. Железо обозначено символом «Fe», а медь обозначается символом «Cu».
Большинство элементов периодической таблицы — это металлы, и они, как правило, находятся в левой части таблицы. Они группируются вместе, потому что обладают определенными физическими и химическими свойствами.Например, металлы плотные, блестящие, они хорошие проводники тепла и электричества, и они легко теряют электроны в химических реакциях. Напротив, неметаллы имеют противоположные свойства. Они не плотные, не проводят тепло и электричество, и стремятся получить электроны, а не отдать их.
Когда мы смотрим в периодическую таблицу, мы видим, что большинство неметаллов сгруппированы справа. Это такие элементы, как гелий, углерод, азот и кислород.
Что такое тяжелые металлы?
Список металлов достаточно многочисленный. Некоторые из них могут накапливаться в организме и не наносить ему при этом вреда, как например, природный стронций (формула Sr), который является аналогом кальция, так как продуктивно откладывается в костной ткани. Какие из них называются тяжелыми и почему? Рассмотрим четыре примера: свинец, медь, ртуть и мышьяк.
Где находятся эти элементы и как они влияют на окружающую среду и здоровье человека? Тяжелые металлы представляют собой металлические, встречающиеся в природе соединения, которые имеют очень высокую плотность по сравнению с другими металлами — по меньшей мере, они в пять раз больше плотности воды. Они токсичны для людей. Даже небольшие дозы могут привести к серьезным последствиям.
- Свинец. Это тяжелый металл, являющийся токсичным для людей, особенно для детей. Отравление этим веществом может привести к проблемам неврологического характера. Несмотря на то что когда-то он был весьма привлекательным из-за его гибкости, высокой плотности и способности поглощать вредное излучение, свинец был выведен из употребления по многим направлениям. Этот мягкий серебристый металл, который встречается на Земле, является опасным для людей и накапливается в организме в течение долгого времени. Самое страшное, что от него нельзя избавиться. Он сидит там, накапливается и постепенно отравляет тело. Свинец токсичен для нервной системы и может вызвать серьезное повреждение головного мозга у детей. Он широко использовался в 1800-х годах для создания макияжа и вплоть до 1978 года использовался в качестве одного из ингридиентов в краске для волос. Сегодня свинец используется в основном в больших батареях, в качестве экранов для рентгеновских лучей или изоляции для радиоактивного материала.
- Медь. Это красновато-коричневый тяжелый металл, у которого есть множество применений. Медь по-прежнему является одним из лучших проводников электричества и тепла, и многие электрические провода сделаны из этого металла и покрыты пластиком. Монеты, в основном мелочь, также делают из этого элемента периодической системы. Острые отравления медью встречаются редко, но, как и свинец, она может накапливаться в тканях, что в конечном итоге приводит к токсичности. Люди, которые подвергаются воздействию большим количеством меди или медной пыли, также находятся в зоне риска.
- Ртуть. Этот металл токсичен в любой форме и может даже поглощаться кожей. Его уникальность состоит в том, что он является жидким при комнатной температуре, его иногда называют «быстрым серебром». Его можно увидеть в термометре, потому что в качестве жидкости он поглощает тепло, изменяя объем даже с малейшей разницей в температуре. Это позволяет ртути подниматься или падать в стеклянной трубке. Поскольку это вещество является мощным нейротоксином, многие компании переходят на спиртовые термометры, окрашенные в красный цвет.
- Мышьяк. Со времен Римской империи вплоть до викторианской эпохи мышьяк считался «королем ядов», а также «ядом царей». История пронизана бесчисленными примерами как королевских лиц, так и простых людей, совершающих убийства для личной выгоды, используя соединения мышьяка, у которых не было ни запаха, ни цвета, ни вкуса. Несмотря на все отрицательные влияния, этот металлоид также имеет свои области применения, даже в медицине. Например, триоксид мышьяка является очень эффективным препаратом, используемым для лечения людей с острым промиелоцитарным лейкозом.
Активные металлы список в химии — Справочник металлиста

Когда люди слышат слово «металл», то обычно оно ассоциируется с холодным и твердым веществом, проводящим электрический ток. Однако металлы и их сплавы могут очень сильно отличаться между собой.
Есть те, которые относятся к группе тяжелых, эти вещества имеют самую высокую плотность.
А некоторые, к примеру, литий, настолько легки, что могли бы плавать в воде, если бы только не вступали с ней в активную реакцию.
Какие металлы активны наиболее всего?
Но какой металл проявляет наиболее интенсивные свойства? Самый активный металл – это цезий. По активности среди всех металлов он занимает первое место. Также его «собратьями» считаются франций, находящийся на втором месте, и унуненний. Но о свойствах последнего ученым пока известно мало.
Цезий – это элемент, который, подобно металлу галлию, легко расплавить в руках. Сделать это, правда, можно лишь при одном условии: если цезий находится в стеклянной ампуле.
В противном случае металл может быстро вступить в реакцию с окружающим воздухом – воспламенится. А взаимодействие цезия с водой сопровождается взрывом – таков в своем проявлении самый активный металл.
Это ответ на вопрос о том, почему так сложно помещать в контейнеры цезий.
Для того чтобы его поместить внутрь пробирки, необходимо, чтобы она была изготовлена из специального стекла и наполнена аргоном или водородом. Температура плавления цезия составляет 28,7 оС.
При комнатной температуре металл находится в полужидком состоянии. Цезий представляет собой вещество золотисто-белого цвета. В жидком состоянии металл хорошо отражает свет.
Пары цезия имеют зеленовато-синий оттенок.
Самый активный металл был первым химическим элементом, наличие которого в поверхности земной коры было обнаружено при помощи метода спектрального анализа. Когда ученые получили спектр металла, то в нем они увидели две линии небесно-голубого цвета. Таким образом и получил свое название этот элемент. Слово caesius в переводе с латинского языка значит «небесно-голубой».
История открытия
Его открытие принадлежит немецким исследователям Р. Бунзену и Г. Кирхгофу. Уже тогда ученые интересовались, какие металлы активные, а какие – нет. В 1860 году исследователи изучали состав воды из Дюркгеймского водохранилища. Делали они это при помощи спектрального анализа. В образце воды ученые обнаружили такие элементы, как стронций, магний, литий, кальций.
Затем они решили проанализировать каплю воды при помощи спектроскопа. Тогда они и увидели две ярко-голубые линии, находящиеся недалеко друг от друга. Одна из них по своему положению практически совпадала с линией металла стронция. Ученые решили, что выявленное ими вещество является неизвестным и отнесли его к группе щелочных металлов.
В том же году Бунзен написал письмо своему коллеге-фотохимику Г. Роско, в котором рассказывал об этом открытии. А официально о цезии было сообщено 10 мая 1860 года на заседании ученых Берлинской академии.
Через шесть месяцев Бунзен смог выделить около 50 граммов хлороплатинита цезия. Ученые переработали 300 тонн минеральной воды и выделили порядка 1 кг хлорида лития в качестве побочного продукта, чтобы в конечном счете получить самый активный металл.Это говорит о том, что цезия в минеральных водах содержится очень мало.
Сложность получения цезия постоянно толкает ученых на поиск содержащих его минералов, одним из которых является поллуцит. Но извлечение цезия из руд всегда оказывается неполным, в процессе эксплуатации цезий очень быстро рассеивается.
Это делает его одним из самых труднодоступных веществ в металлургии. В земной коре, к примеру, содержится 3,7 граммов цезия на одну тонну. А в одном литре морской воды лишь 0,5 мкг вещества представляют собой самый активный металл.
Это приводит к тому, что извлечение цезия является одним из самых трудоемких процессов.
Получение в России
Как было указано, главным минералом, из которого получают цезий, является поллуцит. А также этот наиболее активный металл можно получить из редкого авогадрита. В промышленности используется именно поллуцит. Добыча его после распада Советского Союза в России не велась, несмотря на то что еще в те времена были обнаружены гигантские запасы цезия в Вороньей тундре под Мурманском.
К тому моменту, когда отечественная промышленность смогла позволить себе добычу цезия, лицензия на разработку этого месторождения была приобретена компанией из Канады. Сейчас извлечение цезия производит новосибирская компания ЗАО «Завод редких металлов».
Использование цезия
Этот металл используется для изготовления различных фотоэлементов. А также соединения цезия применяются в специальных отраслях оптики – в изготовлении инфракрасных приборов, биноклей ночного видения. Цезий используют в изготовлении прицелов, которые позволяют заметить технику и живую силу врага. Также его применяют для изготовления особых металлогалогенных ламп.
Но этим не исчерпывается круг его применения. На основе цезия был создан также ряд медицинских препаратов. Это лекарства для лечения дифтерии, язвенных болезней, шоков и шизофрении. Как и соли лития, соли цезия обладают нормотимическими свойствами – или, попросту, способны стабилизировать эмоциональный фон.
Металл франций
Еще одним из металлов с самыми интенсивными свойствами является франций. Он получил свое название в честь родины первооткрывательницы металла. М. Пере, родившаяся во Франции, открыла новый химический элемент в 1939 году. Он принадлежит к числу таких элементов, о которых даже сами исследователи-химики затрудняются делать какие-либо выводы.
Франций является самым тяжелым металлом. При этом и самый активный металл – это франций, наряду с цезием. Этим редким сочетанием – высокой химической активностью и низкой ядерной устойчивостью и обладает франций.
У его самого долгоживущего изотопа период полураспада составляет всего лишь 22 минуты. Франций используется для обнаружения другого элемента – актиния. А также соли франция раньше предлагалось применять для обнаружения раковых опухолей.
Однако из-за высокой стоимости эту соль невыгодно производить.
Сравнение самых активных металлов
Унуненний – это пока еще не открытый металл. Он будет занимать первое место в восьмой строке периодической системы.
Разработка и исследования этого элемента проводятся в России в Объединенном институте ядерных исследований. Этот металл должен будет обладать также очень высокой активностью.
Если же сравнивать уже известные франций и цезий, то самым высоким потенциалом ионизации – 380 кДж/моль – будет обладать франций.
У цезия этот показатель составляет 375 кДж/моль. Но реагирует франций все же не так быстро, как цезий. Таким образом, цезий – самый активный металл. Это – ответ (химия чаще всего является тем предметом, в программе которого можно встретить подобный вопрос), который может быть полезным как на уроке в школе, так и в профессионально-техническом училище.
Ряд активности металлов в химии
Все металлы, в зависимости от их окислительно-восстановительной активности объединяют в ряд, который называется электрохимическим рядом напряжения металлов (так как металлы в нем расположены в порядке увеличения стандартных электрохимических потенциалов) или рядом активности металлов:
Li, K, Ва, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, H2, Cu, Hg, Ag, Рt, Au
Наиболее химически активные металлы стоят в ряду активности до водорода, причем, чем левее расположен металл, тем он активнее. Металлы, занимающие в ряду активности, место после водорода считаются неактивными.
Алюминий
Алюминий представляет собой серебристо-белого цвета. Основные физические свойства алюминия – легкость, высокая тепло- и электропроводность. В свободном состоянии при пребывании на воздухе алюминий покрывается прочной пленкой оксида Al2O3, которая делает его устойчивым к действию концентрированных кислот.
Алюминий относится к металлам p-семейства. Электронная конфигурация внешнего энергетического уровня – 3s23p1. В своих соединениях алюминий проявляет степень окисления равную «+3».
Алюминий получают электролизом расплава оксида этого элемента:
2Al2O3 = 4Al + 3O2↑
Однако из-за небольшого выхода продукта, чаще используют способ получения алюминия электролизом смеси Na3[AlF6] и Al2O3. Реакция протекает при нагревании до 960С и в присутствии катализаторов – фторидов (AlF3, CaF2 и др.), при этом на выделение алюминия происходит на катоде, а на аноде выделяется кислород.
Алюминий способен взаимодействовать с водой после удаления с его поверхности оксидной пленки (1), взаимодействовать с простыми веществами (кислородом, галогенами, азотом, серой, углеродом) (2-6), кислотами (7) и основаниями (8):2Al + 6H2O = 2Al(OH)3 +3H2↑ (1)
2Al +3/2O2 = Al2O3 (2)
2Al + 3Cl2 = 2AlCl3 (3)
2Al + N2 = 2AlN (4)
2Al +3S = Al2S3 (5)
4Al + 3C = Al4C3 (6)
2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑ (7)
2Al +2NaOH +3H2O = 2Na[Al(OH)4] + 3H2↑ (8)
Кальций
В свободном виде Ca – серебристо-белый металл. При нахождении на воздухе мгновенно покрывается желтоватой пленкой, которая представляет собой продукты его взаимодействия с составными частями воздуха. Кальций – достаточно твердый металл, имеет кубическую гранецентрированную кристаллическую решетку.
Электронная конфигурация внешнего энергетического уровня – 4s2. В своих соединениях кальций проявляет степень окисления равную «+2».
Кальций получают электролизом расплавов солей, чаще всего – хлоридов:
Ряд активности металлов в химии

Все металлы, в зависимости от их окислительно-восстановительной активности объединяют в ряд, который называется электрохимическим рядом напряжения металлов (так как металлы в нем расположены в порядке увеличения стандартных электрохимических потенциалов) или рядом активности металлов:
Li, K, Ва, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, H2, Cu, Hg, Ag, Рt, Au
Наиболее химически активные металлы стоят в ряду активности до водорода, причем, чем левее расположен металл, тем он активнее. Металлы, занимающие в ряду активности, место после водорода считаются неактивными.
Железо и его соединения
Железо – металл серого цвета. В чистом виде оно довольно мягкое, ковкое и тягучее. Электронная конфигурация внешнего энергетического уровня – [Ar]3d 64s2. В своих соединениях железо проявляет степени окисления «+2» и «+3».
Металлическое железо реагирует с водяным паром, образуя смешанный оксид (II, III) Fe3O4:
3Fe + 4H2O(v) ↔ Fe3O4 + 4H2↑
На воздухе железо легко окисляется, особенно в присутствии влаги (ржавеет):
3Fe + 3O2 + 6H2O = 4Fe(OH)3
Как и другие металлы железо вступает в реакции с простыми веществами, например, галогенами (1), растворяется в кислотах (2):
2Fe + Br2 = 2FeBr3 (при нагревании) (1)
Fe + 2HCl = FeCl2 + H2↑ (2)
Железо образует целый спектр соединений, поскольку проявляет несколько степеней окисления: гидроксид железа (II), гидроксид железа (III), соли, оксиды и т.д. Так, гидроксид железа (II) можно получить при действии растворов щелочей на соли железа (II) без доступа воздуха:
FeSO4 + 2NaOH = Fe(OH)2↓ + Na2SO4
Гидроксид железа (II) растворим в кислотах и окисляется до гидроксида железа (III) в присутствии кислорода.
Соли железа (II) проявляют свойства восстановителей и превращаются в соединения железа (III).
Оксид железа (III) нельзя получить по реакции горения железа в кислороде, для его получения необходимо сжигать сульфиды железа или прокаливать другие соли железа:
4FeS2 + 11O2 = 2Fe2O3 +8SO2↑
2FeSO4 = Fe2O3 + SO2↑ + 3H2O
Соединения железа (III) проявляют слабые окислительные свойства и способны вступать в ОВР с сильными восстановителями:2FeCl3 + H2S = Fe(OH)3↓ + 3NaCl
Производство чугуна и стали
Стали и чугуны – сплавы железа с углеродом, причем содержание углерода в стали до 2%, а в чугуне 2-4%. Стали и чугуны содержат легирующие добавки: стали– Cr, V, Ni, а чугун – Si.
Выделяют различные типы сталей, так, по назначению выделяют конструкционные, нержавеющие, инструментальные, жаропрочные и криогенные стали. По химическому составу выделяют углеродистые (низко-, средне- и высокоуглеродистые) и легированные (низко-, средне- и высоколегированные). В зависимости от структуры выделяют аустенитные, ферритные, мартенситные, перлитные и бейнитные стали.
Стали нашли применение во многих отраслях народного хозяйства, таких как строительная, химическая, нефтехимическая, охрана окружающей среды, транспортная энергетическая и другие отрасли промышленности.
В зависимости от формы содержания углерода в чугуне — цементит или графит, а также их количества различают несколько типов чугуна: белый (светлый цвет излома из-за присутствия углерода в форме цементита), серый (серый цвет излома из-за присутствия углерода в форме графита), ковкий и жаропрочный. Чугуны очень хрупкие сплавы.
Области применения чугунов обширны – из чугуна изготавливают художественные украшения (ограды, ворота), корпусные детали, сантехническое оборудование, предметы быта (сковороды), его используют в автомобильной промышленности.
Примеры решения задач
Химические элементы металлы

Металлы — элементы, составляющие окружающую нас природу. Сколько существует Земля, столько существуют и металлы.
Земная кора содержит следующие металлы:
- алюминий — 8,2%,
- железо — 4,1%,
- кальций — 4,1%,
- натрий — 2,3%,
- магний — 2,3%,
- калий — 2,1 %,
- титан — 0,56% и т.д.
На данный момент наука обладает информацией о 118 химических элементах. Восемьдесят пять элементов из этого списка относятся к металлам.
Химические свойства металлов
Для того чтобы понять, от чего зависят химические свойства металлов, обратимся к авторитетному источнику – таблице периодической системе элементов, т.н. таблице Менделеева. Проведем диагональ (можно мысленно) между двумя точками: начнем от Be (бериллий) и закончим на At (астат).
Деление это конечно условно, но все-таки позволяет объединять химические элементы в соответствии с их свойствами. Элементы, находящиеся слева под диагональю, и будут металлами.
Чем левее, относительно диагонали, расположение элемента, тем более выражены будут у него металлические свойства:
- кристаллическая структура — плотная,
- теплопроводность — высокая,
- электрическая проводимость, уменьшающаяся с повышением температуры,
- уровень степени ионизации — низкий (электроны отделяются свободно)
- способность к образованию соединений (сплавы),
- растворимость (растворяются в сильных кислотах и едких щелочах),
- окисляемость (образование оксидов).
Вышеперечисленные свойства металлов зависят от наличия электронов, свободно перемещающихся в кристаллической решетке. У элементов, расположенных рядом с диагональю, или непосредственно в месте ее прохождения, имеют двойственные признаки принадлежности, т.е. имеют свойства металлов и неметаллов.
Радиусы атомов металлов имеют сравнительно большие размеры. Внешние электроны, называемые валентными, значительно удалены от ядра и, как следствие, слабо связаны с ним. Поэтому атомы металлов легко отдают валентные электроны и образуют положительно заряженные ионы (катионы).
Эта особенность является основным химическим свойством металлов. Атомы элементов с наиболее выраженными металлическими свойствами на внешнем энергетическом уровне имеют от одного до трех электронов.
Химические элементы с характерно выраженными признаками металлов образуют только положительно заряженные ионы, они совсем не способны присоединять электроны.
Вытеснительный ряд М. В. Бекетова
Активность металла и скорость реакции его взаимодействия с другими веществами зависит от величины показателя способности атома «расстаться с электронами». Способность различно выражена у разных металлов. Элементы, обладающие высокими показателями, являются активными восстановителями.
Чем больше масса атома металла, тем выше его восстановительная способность. Самыми сильными восстановителями считаются щелочные металлы K, Ca, Na. Если атомы металла не способны отдать электроны, то такой элемент будет считаться окислителем, например: аурид цезия может окислять другие металлы.
В этом отношении наиболее активны соединения щелочных металлов.
Русский ученый М. В. Бекетов первым начал изучать явление вытеснения одних металлов, из соединений образованных ими, другими металлами. Составленный им перечень металлов, в котором они расположены в соответствии со степенью увеличения нормальных потенциалов, получил название «электрохимического ряда напряжений» (вытеснительный ряд Бекетова).
Li K Rb Cs Ca Na Mg Al Mn Zn Cr Cr Fe Ni Sn Pb Cu Hg Ag Pt Ag Pt AuЧем правее расположен металла в этом ряду, тем ниже его восстановительные свойства, и тем сильнее окислительные свойства его ионов.
Классификация металлов по Менделееву
В соответствии с таблицей Менделеева различаются следующие виды (подгруппы) металлов:
- щелочные — Li (литий), Na (натрий), K (калий), Rb (рубидий), Cs (цезий), Fr (франций);
- щелочноземельные – Be (бериллий), Mg (магний), Ca (кальций), Sr (стронций), Ba (барий), Ra (радий);
- легкие — AL (алюминий), In (индий), Cd (кадмий), Zn (цинк);
- переходные;
- полуметаллы
Техническое применение металлов
Металлы, нашедшие более или менее широкое техническое применение, условно делятся на три группы: черные, цветные и благородные.
К черным металлам относят железо и его сплавы: сталь, чугун и ферросплавы.
Следует сказать, что железо – самый распространенный в природе металл. Его химическая формула Fe (феррум). Железо сыграло огромную роль в эволюции человека. Человек смог получить новые орудия труда, научившись выплавлять железо. В современной промышленности широко применяются сплавы железа, полученные путём добавления в железо углерода или других металлов.
Цветные металлы – это практически все металлы за исключением железа, его сплавов и благородных металлов. По своим физическим свойствам цветные металлы классифицируют следующим образом:
· тяжёлые металлы: медь, никель, свинец, цинк, олово;
· лёгкие металлы: алюминий, титан, магний, бериллий, кальций, стронций, натрий, калий, барий, литий, рубидий, цезий;
· малые металлы: висмут, кадмий, сурьма, ртуть, кобальт, мышьяк;
· тугоплавкие металлы: вольфрам, молибден, ванадий, цирконий, ниобий, тантал, марганец, хром;
· редкие металлы: галлий, германий, индий, цирконий;
Благородные металлы: золото, серебро, платина, родий, палладий, рутений, осмий.
Нужно сказать, что с золотом человек познакомился гораздо раньше, чем с железом. Золотые украшения из этого металла делали ещё в Древнем Египте. В наше время золото используется ещё и в микроэлектронике и других отраслях промышленности.
Серебро, как и золото, используется в ювелирной промышленности, микроэлектронике, фармацевтической промышленности.
Металлы сопровождают человека на протяжении всей истории человеческой цивилизации. Нет такой отрасли, где не использовались бы металлы. Без металлов и их соединений невозможно представить современную жизнь.
Щелочные металлы

К щелочным металлам относят химические элементы: одновалентные металлы, составляющие Ia группу: литий, натрий, калий, рубидий, цезий и франций.
Эти металлы очень активны, быстро окисляются на воздухе и бурно реагируют с водой. Их хранят под слоем керосина из-за их сильной реакционной способности.
Общая характеристика
От Li к Fr (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств, реакционной способности. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns1:
- Li — 2s1
- Na — 3s1
- K — 4s1
- Rb — 5s1
- Cs — 6s1
- Fr — 7s1
Природные соединения
В природе щелочные металлы встречаются в виде следующих соединений:
- NaCl — галит (каменная соль)
- KCl — сильвит
- NaCl*KCl — сильвинит
Получение
Получить такие активные металлы электролизом водного раствора — невозможно. Для их получения применяют электролиз расплавов при высоких температурах (естественно — безводных):
NaCl → Na + Cl2↑ (электролиз расплава каменной соли)
Химические свойства
- Реакция с кислородом
- Реакции с неметаллами
- Реакция с водой
- Окрашивание пламени
Одной из особенностей щелочных металлов является их реакция с кислородом. Литий в такой реакции преимущественно образует оксид, натрий — пероксид, калий, рубидий и цезий — супероксиды.
Li + O2 → Li2O (оксид лития)
Na + O2 → Na2O2 (пероксид натрия)
K + O2 → KO2 (супероксид калия)
Помните, что металлы никогда не принимают отрицательных степеней окисления. Щелочные металлы одновалентны, и проявляют постоянную степень окисления +1 в различных соединениях: гидриды, галогениды (фториды, хлориды, бромиды и йодиды), нитриды, сульфиды и т.д.
Li + H2 → LiH (в гидридах водород -1)
Na + F2 → NaF (в фторидах фтор -1)
Na + S → Na2S (в сульфидах сера -2)
K + N2 → K3N (в нитридах азот -3)
Щелочные металлы бурно взаимодействуют с водой, при этом часто происходит воспламенение, а иногда — взрыв.
Na + H2O → NaOH + H2↑ (воду можно представить в виде HOH — натрий вытесняет водород)
Иногда в задачах может проскользнуть фраза такого плана: «… в ходе реакции выделился металл, окрашивающий пламя горелки в желтый цвет». Тут вы сразу должны догадаться: речь, скорее всего, про натрий.
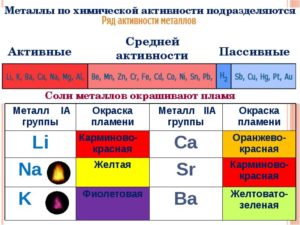
Щелочные металлы по-разному окрашивают пламя. Литий окрашивает в алый цвет, натрий — в желтый, калий — в фиолетовый, рубидий — синевато-красный, цезий — синий.
Оксиды щелочных металлов
Имеют общую формулу R2O, например: Na2O, K2O.
Гидроксиды щелочных металлов
Относятся к щелочам — растворимым основаниям. Наиболее известные представители: NaOH — едкий натр, KOH — едкое кали.