Какие металлы обладают постоянной валентностью
Какие металлы обладают постоянной валентностью
Существует несколько определений понятия «валентность». Чаще всего этим термином называют способность атомов одного элемента присоединять определённое число атомов других элементов. Часто у тех, кто только начинает изучать химию, возникает вопрос: Как определить валентность элемента?. Сделать это несложно, зная несколько правил.
Валентности постоянные и переменные
Рассмотрим соединения HF, H2S и CaH2. В каждом из этих примеров один атом водорода присоединяет к себе только один атом другого химического элемента, значит его валентность равна одному. Значение валентности записывают над символом химического элемента римскими цифрами.
В приведённом примере атом фтора связан только с одним одновалентным атомом H, значит валентность его тоже равна 1. Атом серы в H2S присоединяет к себе уже два атома H, поэтому она в данном соединении двухвалентна. С двумя водородными атомами связан и кальций в его гидриде CaH2, а значит, и его валентность равна двум.
Кислород в подавляющем большинстве своих соединений двухвалентен, то есть образует две химические связи с другими атомами.
Атом серы в первом случае присоединяет к себе два кислородных атома, то есть всего образует 4 химические связи (один кислород образует две связи, значит сера — два раза по 2), то есть валентность ее равна 4.В соединении SO3 сера присоединяет уже три атома O, поэтому и валентность ее равна 6 (три раза образует по две связи с каждым атомом кислорода). Атом кальция же присоединяет только один атом кислорода, образуя с ним две связи, значит, его валентность такая же, как и у O, то есть равна 2.
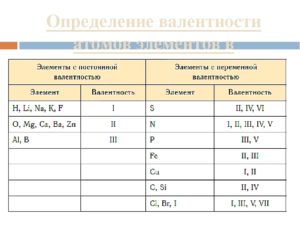
Обратите внимание на то, что атом H одновалентен в любом соединении. Всегда (кроме иона гидроксония H3O(+)) равна 2 валентность кислорода. По две химические связи как с водородом, так и с кислородом образует кальций. Это элементы с постоянной валентностью. Кроме уже указанных, постоянную валентность имеют:
- Li, Na, K, F — одновалентны;
- Be, Mg, Ca, Zn, Cd — обладают валентностью, равной II;
- B, Al и Ga — трехвалентны.
Атом серы, в отличие от рассмотренных случаев, в соединении с водородом имеет валентность, равную II, а с кислородом может быть и четырех- и шестивалентна. Про атомы таких элементов говорят, что они имеют переменную валентность. При этом максимальное ее значение в большинстве случаев совпадает с номером группы, в которой находится элемент в Периодической системе (правило 1).
Из этого правила есть много исключений. Так, элемент 1 группы медь, проявляет валентности и I, и II. Железо, кобальт, никель, азот, фтор, напротив, имеют максимальную валентность, меньшую, чем номер группы. Так, для Fe, Co, Ni это II и III, для N — IV, а для фтора — I.
Минимальное значение валентности всегда соответствует разнице между числом 8 и номером группы (правило 2).
Однозначно определить, какова же валентность элементов, у которых она переменная, можно только по формуле определенного вещества.
Определение валентности в бинарном соединении
Рассмотрим, как определить валентность элемента в бинарном (из двух элементов) соединении. Здесь возможны два варианта: в соединении валентность атомов одного элемента известна точно или же обе частицы с переменной валентностью.
Случай первый:
- Fe2O3 — валентность кислорода постоянна и равна II. Три атома О имеют 2 × 3 = 6 единиц валентности.
- Далее работаем по правилу: суммарное число единиц валентности для атомов одного элемента совпадает с числом единиц валентности для атомов другого вида (правило 3).
- Согласно этому правилу, общее число единиц валентности для железа тоже равно 6.
- Разделим общее число валентных единиц на количество атомов железа, то есть на 2, и получим валентность железа, равную III.
Случай второй:
- SnCI4 — оба атома с переменной валентностью. Применяем ещё одно правило: в бинарном соединении элемент, стоящий на втором месте, имеет минимальную валентность. В соединениях металлов с неметаллами на втором месте записывают неметалл. В формуле вещества, состоящего только из неметаллов, на втором месте пишут символ того элемента, который в ПСХЭ находится правее или выше.
- В приведённом примере Sn (олово) — металл, CI — неметалл, соответственно он и будет иметь минимальную валентность. Её определим, исходя из правила 2: 8 — 7 = 1
- Далее определим суммарное число единиц валентности у хлора: 4 × 1= 4
- Воспользуемся правилом 3. Суммарное количество валентных единиц олова тоже будет равно 4. Все они приходятся на один атом Sn, значит, это и есть его валентность.
Определение валентности по формуле трехэлементной частицы
Далеко не все химические вещества состоят из двухатомных молекул. Как определить валентность элемента в трёхэлементной частице? Рассмотрим этот вопрос на примере формул двух соединения K2Cr2O7.
- Cr здесь называют центральным атомом. Необходимо помнить, что все остальные атомы связаны с ним через кислородные мостики. Исходя из этого, и будем производить вычисления.
- Кислород — элемент с постоянной валентностью, равной двум. Калий всегда одновалентен.
- Всего атомы O образуют 7 × 2 = 14 единиц валентности, а атомы калия 1 × 2 = 2.
- Из 14 валентных единиц атом серы два расходует на присоединение калия, следовательно, на хром их остаётся 14 — 2 = 12.
- Это число единиц валентности приходится на 2 атома Cr, значит, на один атом приходится 12÷2=6.
Если же вместо калия в формуле будет присутствовать железо, или другой элемент с переменной валентностью, нам потребуется знать, какова же валентность кислотного остатка. Например, нужно вычислить валентности атомов всех элементов в соединении с формулой FeSO4.
- Атом кислорода двухвалентен, всего на кислород приходится II × 4 = 8 единиц валентности.
- Валентность кислотного остатка SO4 равна II (как ее определить, написано в статье «Формулы кислот»).
- По правилу 3 валентность железа в этом случае тоже равна II.
- Центральный атом здесь S. Кислород присоединяет один атом железа, расходуя на него две валентные единицы, следовательно, на серу их остаётся 8 — 2 = 6 единиц валентности. Так как в формуле FeSO4 один атом серы, то это и есть ее валентность.
Следует отметить, что термин «валентность» чаще использую в органической химии. При составлении формул неорганических соединений чаще используют понятие «степень окисления».
Как определить валентность по периодической таблице Менделеева: что это такое, изучение свойств химических элементов
Атомы химических элементов могут образовывать различное число связей. Эта способность имеет специальное название – валентность.
Давайте разберемся, как определить валентность по таблице Менделеева, узнаем, в чем заключается ее отличие от степени окисления, увидим закономерности, характерные для водорода, углерода, фосфора, цинка, научимся находить валентность химических элементов.
Основные сведения
Валентность – это возможность атомов различных химических элементов образовывать связи между собой. Другими словами можно сказать, что это способность атома присоединить к себе определенное количество других атомов.
Важно! Это не всегда постоянное число для одного и того же элемента. В разных соединениях элемент может обладать различными значениями.
Определение по таблице Д.И. Менделеева
Для определения этой способности атома по таблице Менделеева необходимо знать, что такое группы и подгруппы периодической таблицы.
Это вертикальные столбцы, которые делят все элементы по определенному признаку. В зависимости от признака, выделяют подразделения элементов.
Этими столбцами элементы делятся на тяжелые и легкие элементы, а также подгруппы — галогены, инертные газы и тому подобное.
Итак, для определения способности элемента образовывать связи нужно руководствоваться двумя правилами:
- Высшая валентность элемента равна номеру его группы.
- Низшая валентность находится как разница между числом 8 и номером группы, в которой расположен данный элемент.
Например, фосфор проявляет высшую валентность V – P2O5 и низшую (8-5)=3– PF3.
Стоит также отметить несколько основных характеристик и особенностей при определении этого показателя:
- Валентность водорода всегда I – H2O, HNO3, H3PO4.
- Валентность кислорода всегда равна II – CO2, SO3.
- У металлов, которые расположены в главной подгруппе, этот показатель всегда равен номеру группы – Al2O3, NaOH, KH.
- Для неметаллов чаще всего проявляются только две валентности – высшая и низшая.
Валентность химических элементов (Таблица)
Валентность химических элементов – это способность у атомов хим. элементов образовывать некоторое число химических связей. Принимает значения от 1 до 8 и не может быть равна 0. Определяется числом электронов атома затраченых на образование хим. связей с другим атомом. Валентность это реальная величина. Обозначается римскими цифрами (I ,II, III, IV, V, VI, VII, VIII).
Как можно определить валентность в соединениях:
— Валентность водорода (H) постоянна всегда 1. Отсюда в соединении H2O валентность O равна 2.
— Валентность кислорода (O) постоянна всегда 2. Отсюда в соединении СО2 валентность С равно 4.
— Высшая валентность всегда равна № группы.
— Низшая валентность равна разности между числом 8 (количество групп в Таблице Менделеева) и номером группы, в которой находится элемент.
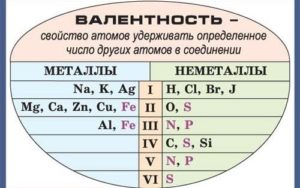
— У металлов в подгруппах А таблицы Менделеева, валентность = № группы.
— У неметаллов обычно две валентности: высшая и низшая.
Валентность химических элементов может быть постоянной и переменной. Постоянная в основном у металлов главных подгрупп, переменная у неметаллов и металлов побочных подгруп.
Таблица валентности химических элементов
| Атомный № | Химический элемент | Символ | Валентность химических элементов | Примеры соединений |
| 1 | Водород / Hydrogen | H | I | HF |
| 2 | Гелий / Helium | He | отсутствует | — |
| 3 | Литий / Lithium | Li | I | Li2O |
| 4 | Бериллий / Beryllium | Be | II | BeH2 |
| 5 | Бор / Boron | B | III | BCl3 |
| 6 | Углерод / Carbon | C | IV, II | CO2, CH4 |
| 7 | Азот / Nitrogen | N | III, IV | NH3 |
| 8 | Кислород / Oxygen | O | II | H2O, BaO |
| 9 | Фтор / Fluorine | F | I | HF |
| 10 | Неон / Neon | Ne | отсутствует | — |
| 11 | Натрий / Sodium | Na | I | Na2O |
| 12 | Магний / Magnesium | Mg | II | MgCl2 |
| 13 | Алюминий / Aluminum | Al | III | Al2O3 |
| 14 | Кремний / Silicon | Si | IV | SiO2, SiCl4 |
| 15 | Фосфор / Phosphorus | P | III, V | PH3, P2O5 |
| 16 | Сера / Sulfur | S | VI, IV, II | H2S, SO3 |
| 17 | Хлор / Chlorine | Cl | I, III, V, VII | HCl, ClF3 |
| 18 | Аргон / Argon | Ar | отсутствует | — |
| 19 | Калий / Potassium | K | I | KBr |
| 20 | Кальций / Calcium | Ca | II | CaH2 |
| 21 | Скандий / Scandium | Sc | III | Sc2S3 |
| 22 | Титан / Titanium | Ti | II, III, IV | Ti2O3, TiH4 |
| 23 | Ванадий / Vanadium | V | II, III, IV, V | VF5, V2O3 |
| 24 | Хром / Chromium | Cr | II, III, VI | CrCl2, CrO3 |
| 25 | Марганец / Manganese | Mn | II, III, IV, VI, VII | Mn2O7, Mn2(SO4)3 |
| 26 | Железо / Iron | Fe | II, III | FeSO4, FeBr3 |
| 27 | Кобальт / Cobalt | Co | II, III | CoI2, Co2S3 |
| 28 | Никель / Nickel | Ni | II, III, IV | NiS, Ni(CO)4 |
| 29 | Медь / Copper | Сu | I, II | CuS, Cu2O |
| 30 | Цинк / Zinc | Zn | II | ZnCl2 |
| 31 | Галлий / Gallium | Ga | III | Ga(OH)3 |
| 32 | Германий / Germanium | Ge | II, IV | GeBr4, Ge(OH)2 |
| 33 | Мышьяк / Arsenic | As | III, V | As2S5, H3AsO4 |
| 34 | Селен / Selenium | Se | II, IV, VI, | H2SeO3 |
| 35 | Бром / Bromine | Br | I, III, V, VII | HBrO3 |
| 36 | Криптон / Krypton | Kr | VI, IV, II | KrF2, BaKrO4 |
| 37 | Рубидий / Rubidium | Rb | I | RbH |
| 38 | Стронций / Strontium | Sr | II | SrSO4 |
| 39 | Иттрий / Yttrium | Y | III | Y2O3 |
| 40 | Цирконий / Zirconium | Zr | II, III, IV | ZrI4, ZrCl2 |
| 41 | Ниобий / Niobium | Nb | I, II, III, IV, V | NbBr5 |
| 42 | Молибден / Molybdenum | Mo | II, III, IV, V, VI | Mo2O5, MoF6 |
| 43 | Технеций / Technetium | Tc | I — VII | Tc2S7 |
| 44 | Рутений / Ruthenium | Ru | II — VIII | RuO4, RuF5, RuBr3 |
| 45 | Родий / Rhodium | Rh | I, II, III, IV, V | RhS, RhF3 |
| 46 | Палладий / Palladium | Pd | I, II, III, IV | Pd2S, PdS2 |
| 47 | Серебро / Silver | Ag | I, II, III | AgO, AgF2, AgNO3 |
| 48 | Кадмий / Cadmium | Cd | II | CdCl2 |
| 49 | Индий / Indium | In | III | In2O3 |
| 50 | Олово / Tin | Sn | II, IV | SnBr4, SnF2 |
| 51 | Сурьма / Antimony | Sb | III, IV, V | SbF5, SbH3 |
| 52 | Теллур / Tellurium | Te | VI, IV, II | TeH2, H6TeO6 |
| 53 | Иод / Iodine | I | I, III, V, VII | HIO3, HI |
| 54 | Ксенон / Xenon | Xe | II, IV, VI, VIII | XeF6, XeO4, XeF2 |
| 55 | Цезий / Cesium | Cs | I | CsCl |
| 56 | Барий / Barium | Ba | II | Ba(OH)2 |
| 57 | Лантан / Lanthanum | La | III | LaH3 |
| 58 | Церий / Cerium | Ce | III, IV | CeO2 , CeF3 |
| 59 | Празеодим / Praseodymium | Pr | III, IV | PrF4, PrO2 |
| 60 | Неодим / Neodymium | Nd | III | Nd2O3 |
| 61 | Прометий / Promethium | Pm | III | Pm2O3 |
| 62 | Самарий / Samarium | Sm | II, III | SmO |
| 63 | Европий / Europium | Eu | II, III | EuSO4 |
| 64 | Гадолиний / Gadolinium | Gd | III | GdCl3 |
| 65 | Тербий / Terbium | Tb | III, IV | TbF4, TbCl3 |
| 66 | Диспрозий / Dysprosium | Dy | III | Dy2O3 |
| 67 | Гольмий / Holmium | Ho | III | Ho2O3 |
| 68 | Эрбий / Erbium | Er | III | Er2O3 |
| 69 | Тулий / Thulium | Tm | II, III | Tm2O3 |
| 70 | Иттербий / Ytterbium | Yb | II, III | YO |
| 71 | Лютеций / Lutetium | Lu | III | LuF3 |
| 72 | Гафний / Hafnium | Hf | II, III, IV | Hr3, HfCl4 |
| 73 | Тантал / Tantalum | Ta | I — V | TaCl5, TaBr2, TaCl4 |
| 74 | Вольфрам / Tungsten | W | II — VI | WBr6, Na2WO4 |
| 75 | Рений / Rhenium | Re | I — VII | Re2S7, Re2O5 |
| 76 | Осмий / Osmium | Os | II — VI, VIII | OsF8, OsI2, Os2O3 |
| 77 | Иридий / Iridium | Ir | I — VI | IrS3, IrF4 |
| 78 | Платина / Platinum | Pt | I, II, III, IV, V | Pt(SO4)3, PtBr4 |
| 79 | Золото / Gold | Au | I, II, III | AuH, Au2O3, Au2Cl6 |
| 80 | Ртуть / Mercury | Hg | II | HgF2, HgBr2 |
| 81 | Талий / Thallium | Tl | I, III | TlCl3, TlF |
| 82 | Свинец / Lead | Pb | II, IV | PbS, PbH4 |
| 83 | Висмут / Bismuth | Bi | III, V | BiF5, Bi2S3 |
| 84 | Полоний / Polonium | Po | VI, IV, II | PoCl4, PoO3 |
| 85 | Астат / Astatine | At | нет данных | — |
| 86 | Радон / Radon | Rn | отсутствует | — |
| 87 | Франций / Francium | Fr | I | — |
| 88 | Радий / Radium | Ra | II | RaBr2 |
| 89 | Актиний / Actinium | Ac | III | AcCl3 |
| 90 | Торий / Thorium | Th | II, III, IV | ThO2, ThF4 |
| 91 | Проактиний / Protactinium | Pa | IV, V | PaCl5, PaF4 |
| 92 | Уран / Uranium | U | III, IV | UF4, UO3 |
| 93 | Нептуний | Np | III — VI | NpF6, NpCl4 |
| 94 | Плутоний | Pu | II, III, IV | PuO2, PuF3, PuF4 |
| 95 | Америций | Am | III — VI | AmF3, AmO2 |
| 96 | Кюрий | Cm | III, IV | CmO2, Cm2O3 |
| 97 | Берклий | Bk | III, IV | BkF3, BkO2 |
| 98 | Калифорний | Cf | II, III, IV | Cf2O3 |
| 99 | Эйнштейний | Es | II, III | EsF3 |
| 100 | Фермий | Fm | II, III | — |
| 101 | Менделевий | Md | II, III | — |
| 102 | Нобелий | No | II, III | — |
| 103 | Лоуренсий | Lr | III | — |
| Номер | Элемент | Символ | Валентность химических элементов | Пример |
Урок 6. Валентность – HIMI4KA

Архив уроков › Химия 8 класс
В уроке 6 «Валентность» из курса «Химия для чайников» дадим определение валентности, научимся ее определять; рассмотрим элементы с постоянной и переменной валентностью, кроме того научимся составлять химические формулы по валентности. Напоминаю, что в прошлом уроке «Химическая формула» мы дали определение химическим формулам и их индексам, а также выяснили различия химических формул веществ молекулярного и немолекулярного строения.
Вы уже знаете, что в химических соединениях атомы разных элементов находятся в определенных числовых соотношениях. От чего зависят эти соотношения?
Рассмотрим химические формулы нескольких соединений водорода с атомами других элементов:
Нетрудно заметить, что атом хлора связан с одним атомом водорода, атом кислорода — с двумя, атом азота — с тремя, а атом углерода — с четырьмя атомами водорода.
В то же время в молекуле углекислого газа СО2 атом углерода связан с двумя атомами кислорода. Из этих примеров видно, что атомы обладают разной способностью соединяться с другими атомами.
Такая способность атомов выражается с помощью численной характеристики, называемой валентностью.
Валентность — численная характеристика способности атомов данного элемента соединяться с другими атомами.
Поскольку один атом водорода может соединиться только с одним атомом другого элемента, валентность атома водорода принята равной единице. Иначе говорят, что атом водорода обладает одной единицей валентности, т. е. он одновалентен.Валентность атома какого-либо другого элемента равна числу соединившихся с ним атомов водорода. Поэтому в молекуле HCl у атома хлора валентность равна единице, а в молекуле H2O у атома кислорода валентность равна двум.
По той же причине в молекуле NH3 валентность атома азота равна трем, а в молекуле CH4 валентность атома углерода равна четырем.
Если условно обозначить единицу валентности черточкой |, вышесказанное можно изобразить схематически:
Следовательно, валентность атома любого элемента есть число, которое показывает, со сколькими атомами одновалентного элемента связан данный атом в химическом соединении.
Численные значения валентности обозначают римскими цифрами над символами химических элементов:
Определение валентности
Однако водород образует соединения далеко не со всеми элементами, а вот кислородные соединения есть почти у всех элементов. И во всех таких соединениях атомы кислорода проявляют валентность, равную двум. Зная это, можно определять валентности атомов других элементов в их бинарных соединениях с кислородом. (Бинарными называются соединения, состоящие из атомов двух химических элементов.)
Чтобы это сделать, необходимо соблюдать простое правило: в химической формуле вещества суммарные числа единиц валентности атомов каждого элемента должны быть одинаковыми.
Так, в молекуле воды H2O общее число единиц валентности двух атомов водорода равно произведению валентности одного атома на соответствующий числовой индекс в формуле:
Так же определяют число единиц валентности атома кислорода:
По величине валентности атомов одного элемента можно определить валентность атомов другого элемента. Например, определим валентность атома углерода в молекуле углекислого газа СО2:Согласно вышеприведенному правилу х·1 = II·2, откуда х = IV.
Существует и другое соединение углерода с кислородом — угарный газ СО, в молекуле которого атом углерода соединен только с одним атомом кислорода:
В этом веществе валентность углерода равна II, так как х·1 = II·1, откуда х = II:
Постоянная и переменная валентность
Как видим, углерод соединяется с разным числом атомов кислорода, т. е. имеет переменную валентность. У большинства элементов валентность — величина переменная. Только у водорода, кислорода и еще нескольких элементов она постоянна (см. таблицу).
Составление химических формул по валентности
Зная валентность элементов, можно составлять формулы их бинарных соединений. Например, необходимо записать формулу кислородного соединения хлора, в котором валентность хлора равна семи. Порядок действий здесь таков.
Еще один пример. Составим формулу соединения кремния с азотом, если валентность кремния равна IV, а азота — III.
Записываем рядом символы элементов в следующем виде:
Затем находим НОК валентностей обоих элементов. Оно равно 12 (IV·III).
Определяем индексы каждого элемента:
Записываем формулу соединения: Si3N4.
В дальнейшем при составлении формул веществ не обязательно указывать цифрами значения валентностей, а необходимые несложные вычисления можно выполнять в уме.
Краткие выводы урока:
- Численной характеристикой способности атомов данного элемента соединяться с другими атомами является валентность.
- Валентность водорода постоянна и равна единице. Валентность кислорода также постоянна и равна двум.
- Валентность большинства остальных элементов не является постоянной. Ее можно определить по формулам их бинарных соединений с водородом или кислородом.
Надеюсь урок 6 «Валентность» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Какие металлы обладают постоянной валентностью — Справочник металлиста

Валентность — это способность атома данного элемента образовывать определенное количество химических связей.
Образно говоря, валентность — это число «рук», которыми атом цепляется за другие атомы. Естественно, никаких «рук» у атомов нет; их роль играют т. н. валентные электроны.
Можно сказать иначе: валентность — это способность атома данного элемента присоединять определенное число других атомов.
Необходимо четко усвоить следующие принципы:
Существуют элементы с постоянной валентностью (их относительно немного) и элементы с переменной валентностью (коих большинство)
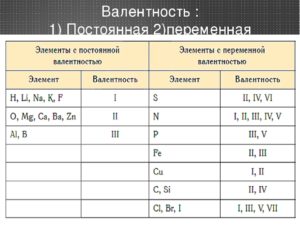
Элементы с постоянной валентностью необходимо запомнить:
| Элементы | Постоянная валентность |
| щелочные металлы (Li, Na, K, Rb , Cs, Fr) | I |
| металлы II группы, главной подгруппы (Be, Mg, Ca, Sr, Ba, Ra) | II |
| алюминий (Al) | III |
| кислород (О) | II |
| фтор (F) | I |
Остальные элементы могут проявлять разную валентность.
Высшая валентность элемента в большинстве случаев совпадает с номером группы, в которой находится данный элемент
Например, марганец находится в VII группе (побочная подгруппа), высшая валентность Mn равна семи. Кремний расположен в IV группе (главная подгруппа), его высшая валентность равна четырем.
Следует помнить, однако, что высшая валентность не всегда является единственно возможной. Например, высшая валентность хлора равна семи (убедитесь в этом!), но известны соединения, в которых этот элемент проявляет валентности VI, V, IV, III, II, I.
Важно запомнить несколько исключений: максимальная (и единственная) валентность фтора равна I (а не VII), кислорода — II (а не VI), азота — IV (способность азота проявлять валентность V — популярный миф, который встречается даже в некоторых школьных учебниках).
Валентность и степень окисления — это не тождественные понятия
Эти понятия достаточно близки, но не следует их путать! Степень окисления имеет знак (+ или -), валентность — нет; степень окисления элемента в веществе может быть равна нулю, валентность равна нулю лишь в случае, если мы имеем дело с изолированным атомом; численное значение степени окисления может НЕ совпадать с валентностью. Например, валентность азота в N2 равна III, а степень окисления = 0. Валентность углерода в муравьиной кислоте = IV, а степень окисления = +2.
Если известна валентность одного из элементов в бинарном соединении, можно найти валентность другого
Делается это весьма просто. Запомните формальное правило: произведение числа атомов первого элемента в молекуле на его валентность должно быть равно аналогичному произведению для второго элемента.
В соединении AxBy: валентность (А) • x = валентность (В) • y
Пример 1. Найти валентности всех элементов в соединении NH3.
Решение. Валентность водорода нам известна — она постоянна и равна I. Умножаем валентность Н на число атомов водорода в молекуле аммиака: 1 • 3 = 3. Следовательно, для азота произведение 1 (число атомов N) на X (валентность азота) также должно быть равно 3. Очевидно, что Х = 3. Ответ: N(III), H(I).
Пример 2. Найти валентности всех элементов в молекуле Cl2O5.
Решение. У кислорода валентность постоянна (II), в молекуле данного оксида пять атомов кислорода и два атома хлора. Пусть валентность хлора = Х. Составляем уравнение: 5 • 2 = 2 • Х. Очевидно, что Х = 5. Ответ: Cl(V), O(II).
Пример 3. Найти валентность хлора в молекуле SCl2, если известно, что валентность серы равна II.
Решение. Если бы авторы задачи не сообщили нам валентность серы, решить ее было бы невозможно. И S, и Cl — элементы с переменной валентностью. С учетом дополнительной информации, решение строится по схеме примеров 1 и 2. Ответ: Cl(I).
В примерах 1 — 3 мы по формуле определяли валентность, попробуем теперь проделать обратную процедуру.
Пример 4. Составьте формулу соединения кальция с водородом.
Решение. Валентности кальция и водорода известны — II и I соответственно. Пусть формула искомого соединения — CaxHy. Вновь составляем известное уравнение: 2 • x = 1 • у. В качестве одного из решений этого уравнения можно взять x = 1, y = 2. Ответ: CaH2.
«А почему именно CaH2? — спросите вы. — Ведь варианты Ca2H4 и Ca4H8 и даже Ca10H20 не противоречат нашему правилу!»
Ответ прост: берите минимально возможные значения х и у. В приведенном примере эти минимальные (натуральные!) значения как раз и равны 1 и 2.«Значит, соединения типа N2O4 или C6H6 невозможны? — спросите вы. — Следует заменить эти формулы на NO2 и CH?»
Нет, возможны. Более того, N2O4 и NO2 — это совершенно разные вещества. А вот формула СН вообще не соответствует никакому реальному устойчивому веществу (в отличие от С6Н6).
Несмотря на все сказанное, в большинстве случаев можно руководствоваться правилом: берите наименьшие значения индексов.
Пример 5. Составьте формулу соединения серы с фтором, если известно, что валентность серы равна шести.
Решение. Пусть формула соединения — SxFy. Валентность серы дана (VI), валентность фтора постоянна (I). Вновь составляем уравнение: 6 • x = 1 • y. Несложно понять, что наименьшие возможные значения переменных — это 1 и 6. Ответ: SF6.
Вот, собственно, и все основные моменты.
А теперь проверьте себя! Предлагаю пройти небольшой тест по теме «Валентность».
Хотите узнать, почему «классическое» определение валентности часто не «работает»? Почему валентность железа в FeO не равна двум? Почему для описания комплексных веществ используется понятие «координационное число»?
Смотрите продолжение этой статьи →
Какие металлы обладают постоянной валентностью
Существует несколько определений понятия «валентность». Чаще всего этим термином называют способность атомов одного элемента присоединять определённое число атомов других элементов. Часто у тех, кто только начинает изучать химию, возникает вопрос: Как определить валентность элемента?. Сделать это несложно, зная несколько правил.
Валентность. Определение валентности. Элементы с постоянной валентностью
Валентность — это способность атома данного элемента образовывать определенное количество химических связей.
Образно говоря, валентность — это число «рук», которыми атом цепляется за другие атомы. Естественно, никаких «рук» у атомов нет; их роль играют т. н. валентные электроны.
Можно сказать иначе: валентность — это способность атома данного элемента присоединять определенное число других атомов.
Необходимо четко усвоить следующие принципы:
Валентность и степень окисления — это не тождественные понятия
Эти понятия достаточно близки, но не следует их путать! Степень окисления имеет знак (+ или -), валентность — нет; степень окисления элемента в веществе может быть равна нулю, валентность равна нулю лишь в случае, если мы имеем дело с изолированным атомом; численное значение степени окисления может НЕ совпадать с валентностью. Например, валентность азота в N2 равна III, а степень окисления = 0. Валентность углерода в муравьиной кислоте = IV, а степень окисления = +2.