Кристаллическая структура меди
Медь самородная формула свойства

Синонимы: Купрокупритом были названы тонкие смеси самородной меди и куприта (Вернадский, 1910). Витнеит—whitneyite (Гент, 1859) и дарвинит (Форбс, 1860) — мышьяковистая медь, образующая смеси с альгодонитом.
Группа
Происхождение названия
Латинское наименование меди cuprum происходит от названия острова Кипр, откуда в древности ввозили медь. Происхождение русского названия неясно.
Английское название минерала Медь — Copper
Медный самородок
- Химический состав
- Разновидности
- Кристаллографическая характеристика
- Форма нахождения в природе
- Физические свойства
- Химические свойства. Прочие свойства
- Диагностические признаки. Спутники.
- Происхождение минерала
- Месторождения
- Практическое применение
- Физические методы исследования
- Кристаллооптические свойства в тонких препаратах (шлифах)
- Купить
Химический состав
Содержит иногда примеси Fe, Ag, Pb, Au, Hg, Bi, Sb, V, Ge3 (серебристая медь с 3—4% Ag, железистая—2,5% Fe и золотистая—2—3% Au). Примеси наблюдаются чаще в первичной самородной меди; вторичная медь обычно более чистая. Состав самородной меди из Шамлугского месторождения (Армения): Cu — 97,20 —97,46%, Fe — 0,25%; в меди из месторождений Алтая определено 98,3% Cu и более.
Кристаллографическая характеристика
Сингония. Кубическая.
Класс. Гексоктаэдрический.
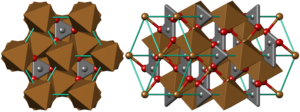
Кристаллическая структура
Для кристаллической структуры характерна гранецентрированная решетка; по углам и в центрах граней элементарного куба расположены атомы меди.
Это формальное выражение того, что в структуре меди имеется плотнейшая упаковка (так называемая кубическая плотнейшая упаковка) из атомов металла с радиусом 1,27 А и расстоянием между ближайшими атомами 2,54 А при выполнении пространства в 74,05%.
Каждый атом Cu окружен 12 ему подобными (координационное число 12), располагающимися вокруг него по вершинам так называемого Архимедова кубооктаэдра.
Главные формы:а (100), d (110), о (111), l (530), е (210), h (410).
Форма нахождения в природе
Облик кристаллов. Облик кристаллов кубический, тетрагексаэдрический, додекаэдрический, реже — октаэдрический (возможно, псевдоморфозы по куприту). Грани часто шероховатые, с углублениями или возвышениями. Простые кристаллы редки.
Двойники. Двойники срастания по (111) обычны, иногда полисинтетические, часто пластинчатые в направлении двойники оси или удлиненные паралелльны диагонали двойники плоскости. Обычно кристаллы (простые и двойники) неравномерно развиты: вытянуты, укорочены или деформированы.
Характерны дендритовидные формы, представляющие собой однообразные срастания множества кристаллов (единообразно деформированных или правильных) по какому-либо одному направлению.
Таковы, например, двойниковые по (111) кристаллы, вытянутые по оси симметрии 2-го порядка и сросшиеся параллельно граням ромбического додекаэдра) или срастания правильных двойниковых кристаллов, разветвляющиеся по направлению ребер и диагоналей октаэдрических граней, а также параллельные срастания кристаллов, вытянутых в направлении осей 4-го порядка. В сплошных выделениях самородной меди при травлении обнаруживаются признаки собирательной кристаллизации с развитием крупных зерен за счет более мелких зональных зерен неправильной формы.
Агрегаты. Искаженные кристаллы, в одиночных неправильных зернах, дендритовидные сростки, нитевидные, проволочные, моховидные образования, тонкие пластинки, конкреции, порошковатые скопления и сплошные массы весом до нескольких сотен тонн.
Дендриты
Оптические
Цвет в свежем изломе светло-розовый, быстро переходящий в медно-красный, затем в коричневый; часто с желтой или пестрой побежалостью.
Черта медно-красная, блестящая.
Блеск металлический.
Отлив
Прозрачность. Непрозрачна. В тончайших пластинках просвечивает зеленым цветом.
Показатели преломления
Ng = , Nm = и Np =
Механические
Твердость 2,5-3.
Плотность 8,4—8,9
Спайность не наблюдается.
Излом занозистый, крючковатый.
Химические свойства
Легко растворяется в разбавленной HNO3 и в царской водке, в H2SO4— при нагревании, в НСl — с трудом. В водном растворе аммиака растворяется, окрашивая его в синий цвет. В полированных шлифах травится всеми основными реактивами. Внутреннее строение легко выявляется с помощью NH4OH + Н2O2 или НСl+ CrO3 (50%-ный раствор).
Прочие свойства
Очень ковка и тягуча. Электропроводность очень высокая; существенно понижается от примесей.
Поведение при нагревании. Чистая медь плавится при 1083°. Теплопроводность несколько меньше, чем у серебра.
Искусственное получение минерала
Может быть легко получена из расплавов или путем электролиза из растворов солей меди.
Диагностические признаки
Сходные минералы
Узнается по красному цвету свежей поверхности, блестящей черте, средней твердости и ковкости, обычно покрыта зеленоватыми, черными, синими налетами окисленных минералов меди. Под микроскопом в отраженном свете легко определяется по цвету и отражательной способности.
Сопутствующие минералы. Медистое золото, халькозин, кальцит, диопсид, апатит, сфен, магнетит, малахит, барит, кварц, халькопирит.
Происхождение и нахождение
Гидротермальное. Накапливается в россыпях. Как уникальные явления описаны самородки массой до 450 т.
Самородная медь образуется в восстановительных условиях при различных геологических процессах; значительная часть ее выделяется из гидротермальных растворов.
В виде микроскопических выделений наблюдается во многих, преимущественно основных, изверженных породах, подвергшихся воздействию гидротермальных растворов, например, в серпентинизированных перидотитах, дунитах и серпентинитах.
В этом случае возникновение самородной меди, возможно, связано с разложением ранее образовавшихся медных сульфидов, например, кубанита (Урал, Закавказье). Аналогичное происхождение можно приписать самородной меди в амфиболитизированных основных породах Серовского района Свердловской области.В Карабашском месторождении медистого золота Челябинской области самородная медь наблюдается в жилообразных телах диопсидо-гранатовых пород, залегающих среди серпентинитов; для самородной меди здесь характерна ассоциация с медистым золотом, халькозином, кальцитом, диопсидом, апатитом, сфеном, магнетитом и др.
В некоторых древних вулканических породах (мелафирах, диабазах и др.
), метаморфизованных под воздействием паров, газов и гидротермальных растворов, медь выполняет миндалины, образует цемент между минералами измененной лавы, заполняет пустоты и трещины; сопровождается гидротермальными минералами: анальцимом, ломонтитом, пренитом, датолитом, адуляром, хлоритом, эпидотом, пумпелиитом, кварцем, кальцитом. Крупнейшие месторождения этого типа находятся на полуострове Кивино в районе Верхнего озера (штат Мичиган, США), где оруденение приурочено к верхнепротерозойской толще. масса меди добывается из мелафиров и конгломератов, но наиболее крупные выделения меди (до 400 т и более) встречены в кальцитовых жилах, содержащих самородное серебро и домейкит.
Медный самородок
Изменение минерала
Наиболее обычными продуктами изменения самородной меди являются куприт, малахит и азурит.
Месторождения
Выделения самородной меди наблюдались в диабазах Новой Земли, в траппах Сибирской платформы, среди основных эффузивных пород в Италии, на Фарерских островах (Дания), в Новой Шотландии (Канада) и в других местах.
Представителями редких типов гипогенных месторождений самородной меди являются цинково-марганцовое месторождение Франклин (штат Нью-Джерси, США) и марганцовые месторождения Лонгбан и Якобсберг (Швеция).
Гипогенными, по-видимому, являются выделения самородной меди весом до нескольких тонн из ранее разрабатывавшегося месторождения Калмактас в Казахстане, представленные в музеях прекрасными образцами.В зоне окисления, особенно в ее нижних частях, самородная медь в основном является ранним продуктом изменения сульфидных медных минералов, главным образом халькозина.
Она слагает преимущественно выделения неправильной формы, реже — кристаллы и дендритовидные агрегаты.Наиболее часто самородная медь сопровождается халькозином, купритом, кальцитом, лимонитом. Наблюдается в ряде месторождений Казахстана (Джезказган, Беркара, Успенское и др.), Рудного Алтая (Белоусовское, Зыряновское, Чудак, Таловское и др.
), США (Бисби и Клифтон- Моренси в штате Аризона, Тинтик в штате Юта и др.).Частью самородная медь в зоне окисления возникает путем отложения из растворов, содержащих сульфат меди. Такова, например, самородная медь, образующая выделения в полостях среди агрегатов лимонита, иногда в ассоциации с купритом (Меднорудянекое месторождение Свердловской обл. и др.).
Известны псевдоморфозы самородной меди, образовавшиеся в зоне окисления по халькозину, куприту, антлериту, халькантиту, азуриту, кальциту, арагониту и другим минералам.Особенно красивые образцы самородной меди (кристаллы и дендритовидные сростки) происходят из Турьинских рудников Свердловской области.
В некоторых горных выработках из медьсодержащих вод на железных предметах выделяется так называемая цементная медь в виде пленок и корочек. Известны также случаи образования меди на полусгнивших остатках крепежной древесины.
В повышенном количестве самородная медь наблюдается в некоторых осадочных породах (песчаниках, глинах, мергелях), содержащих растительные остатки, в виде выделений неправильной формы, иногда в псевдоморфозах по древесине или в виде конкреций. Таковы, например, пермские медистые песчаники отдельных районов России (Приуралье, Татарстан и др.), песчаники Науката в Киргизияи меловые медистые песчаники Корокоро и Кобрицос в Боливии и др.С восстановительными процессами связано также образование самородной меди в некоторых торфяниках, например,в Свердловской области— по реке Лёвихе в бассейне реки Тагила и в Сысертском районе.
В виде галек и зерен самородная медь встречается в России в некоторых россыпях: на Урале, по Енисею, по реке Б. Сархой в Бурятия, по реке Чорох в Грузии, на Командорских островах и в других местах.
В штате Коннектикут (США) самородная медь обнаружена в ледниковых отложениях в виде выделений весом до 75 кг.Мелкие, неправильной формы выделения самородной меди отмечены в самородном железе метеорита Венгерово в ассоциации с троилитом.
Кристаллическое строение металлов. Кристаллическая решетка металлов

Одним из самых распространенных материалов, с которым всегда предпочитали работать люди, был металл. В каждую эпоху предпочтение отдавалось разным видам этих удивительных веществ. Так, IV-III тысячелетия до нашей эры считаются веком хальколита, или медным. Позже его сменяет бронзовый, а затем в силу вступает тот, что и по сей день является актуальным — железный.
Сегодня вообще сложно представить, что когда-то можно было обходиться без металлических изделий, ведь практически все, начиная от предметов быта, медицинских инструментов и заканчивая тяжелой и легкой техникой, состоит из этого материала или включает в свой состав отдельные части из него. Почему же металлы сумели завоевать такую популярность? В чем проявляются особенности и как это заложено в их строении, попробуем разобраться далее.
Общее понятие о металлах
«Химия. 9 класс» — это учебник, по которому проходят обучение школьники. Именно в нем подробно изучаются металлы. Рассмотрению их физических и химических свойств отведена большая глава, ведь разнообразие их чрезвычайно велико.
Именно с этого возраста рекомендуют давать детям представление о данных атомах и их свойствах, ведь подростки уже вполне могут оценить значение подобных знаний. Они прекрасно видят, что окружающее их разнообразие предметов, машин и прочих вещей имеет в своей основе как раз металлическую природу.
Что же такое металл? С точки зрения химии, к данным атомам принято относить те, что имеют:
- малое число электронов на внешнем уровне;
- проявляют сильные восстановительные свойства;
- имеют большой атомный радиус;
- как простые вещества обладают рядом специфических физических свойств.
Основу знаний об этих веществах можно получить, если рассмотреть атомно-кристаллическое строение металлов. Именно оно объясняет все особенности и свойства данных соединений.
В периодической системе для металлов отводится большая часть всей таблицы, ведь они образуют все побочные подгруппы и главные с первой по третью группу. Поэтому их численное превосходство очевидно. Самыми распространенными являются:
- кальций;
- натрий;
- титан;
- железо;
- магний;
- алюминий;
- калий.
Все металлы имеют ряд свойств, которые позволяют объединять их в одну большую группу веществ. В свою очередь, эти свойства объясняет именно кристаллическое строение металлов.
Свойства металлов
К специфическим свойствам рассматриваемых веществ относят следующие.
- Металлический блеск. Все представители простых веществ им обладают, причем большинство одинаковым серебристо-белым цветом. Лишь некоторые (золото, медь, сплавы) отличаются.
- Ковкость и пластичность — способность деформироваться и восстанавливаться достаточно легко. У разных представителей выражена в неодинаковой мере.
- Электропроводность и теплопроводность — одно из основных свойств, которое определяет области применения металла и его сплавов.
Кристаллическое строение металлов и сплавов объясняет причину каждого из обозначенных свойств и говорит о выраженности их у каждого конкретного представителя. Если знать особенности такого строения, то можно влиять на свойства образца и подстраивать его под нужные параметры, что и делают люди уже многие десятилетия.
Атомно-кристаллическое строение металлов
В чем же заключается такое строение, чем характеризуется? Само название говорит о том, что все металлы представляют собой кристаллы в твердом состоянии, то есть при обычных условиях (кроме ртути, которая является жидкостью). А что такое кристалл?
Это условное графическое изображение, построенное путем пересечения воображаемых линий через атомы, которые выстраивают тело. Другими словами, каждый металл состоит из атомов.
Они располагаются в нем не хаотично, а очень правильно и последовательно.
Так вот, если мысленно соединить все эти частицы в одну структуру, то получится красивое изображение в виде правильного геометрического тела какой-либо формы.
Это и принято называть кристаллической решеткой металла. Она очень сложная и пространственно объемная, поэтому для упрощения показывают не всю ее, а лишь часть, элементарную ячейку.
Совокупность таких ячеек, собранная вместе и отраженная в трехмерном пространстве, и образует кристаллические решетки.
Химия, физика и металловедение — это науки, которые занимаются изучением особенностей строения таких структур.
Сама элементарная ячейка — это набор атомов, которые располагаются на определенном расстоянии друг от друга и координируют вокруг себя строго фиксированное число других частиц.
Она характеризуется плотностью упаковки, расстоянием между составными структурами, координационным числом.
В целом все эти параметры являются характеристикой и всего кристалла, а значит, отражают и проявляемые металлом свойства.
Существует несколько разновидностей кристаллических решеток. Объединяет их все одна особенность — в узлах находятся атомы, а внутри располагается облако электронного газа, которое формируется путем свободного передвижения электронов внутри кристалла.
Типы кристаллических решеток
Четырнадцать вариантов строения решетки принято объединять в три основных типа. Они следующие:
- Объемно-центрированная кубическая.
- Гексагональная плотноупакованная.
- Гранецентрированная кубическая.
Кристаллическое строение металлов было изучено только благодаря электронной микроскопии, когда стало возможным получать большие увеличения изображений. А классификацию типов решеток впервые привел французский ученый Браве, по фамилии которого их иногда называют.
Объемно-центрированная решетка
Строение кристаллической решетки металлов данного типа представляет собой следующую структуру. Это куб, в узлах которого находится восемь атомов. Еще один располагается в центре свободного внутреннего пространства ячейки, что и объясняет название «объемно-центрированная».
Это один из вариантов наиболее простого строения элементарной ячейки, а значит, и всей решетки в целом. Такой тип имеют следующие металлы:
- молибден;
- ванадий;
- хром;
- марганец;
- альфа-железо;
- бетта-железо и другие.
Основные свойства таких представителей — высокая степень ковкости и пластичности, твердость и прочность.
Гранецентрированная решетка
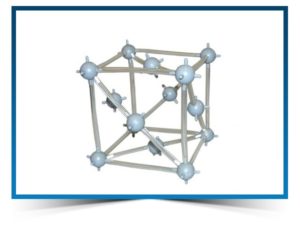
Кристаллическое строение металлов, имеющих гранецентрированную кубическую решетку, представляет собой следующую структуру. Это куб, который включает в свой состав четырнадцать атомов. Восемь из них формируют узлы решетки, а еще шесть расположены по одному на каждой грани.
Подобную структуру имеют:
- алюминий;
- никель;
- свинец;
- гамма-железо;
- медь.
Основные отличительные свойства — блеск разного цвета, легкость, прочность, ковкость, повышенная устойчивость к коррозии.
Гексагональная решетка
Кристаллическое строение металлов, обладающих данным типом решетки, следующее. В основе элементарной ячейки лежит шестигранная призма. В ее узлах располагается 12 атомов, еще два по основаниям и три атома свободно лежат внутри пространства в центре структуры. Всего семнадцать атомов.
Подобную сложную конфигурацию имеют такие металлы, как:
- альфа-титан;
- магний;
- альфа-кобальт;
- цинк.
Основные свойства — высокая степень прочности, сильный серебристый блеск.
Дефекты кристаллического строения металлов
Однако все рассмотренные типы ячеек могут иметь и естественные недостатки, или так называемые дефекты. Это может быть связано с разными причинами: посторонними атомами и примесями в металлах, внешними воздействиями и прочим.
Поэтому существует классификация, отражающая дефекты, которые могут иметь кристаллические решетки. Химия как наука изучает каждый из них с целью выявления причины и способа устранения, чтобы свойства материала не были изменены. Итак, дефекты следующие.
- Точечные. Они бывают трех основных видов: вакансии, примеси или дислоцированные атомы. Приводят к ухудшению магнитных свойств металла, электро- и теплопроводности его.
- Линейные, или дислокационные. Выделяют краевые и винтовые. Ухудшают прочность и качество материала.
- Поверхностные дефекты. Влияют на внешний вид и структуру металлов.
В настоящее время разработаны методики устранения дефектов и получения чистых кристаллов. Однако совсем искоренить их не удается, идеальной кристаллической решетки не существует.
Значение знаний о кристаллическом строении металлов
Из вышеизложенного материала очевидно, что знания о тонкой структуре и строении позволяют спрогнозировать свойства материала и повлиять на них. И это позволяет делать наука химия.
9 класс общеобразовательной школы делает в процессе обучения упор на то, чтобы сформировать у учащихся четкое понятие о важном значении основополагающей логической цепочки: состав — строение — свойства — применение.
Сведения о кристаллическом строении металлов очень четко иллюстрирует эту зависимость и позволяет учителю наглядно объяснить и показать детям, насколько важно знать тонкую структуру, чтобы правильно и грамотно использовать все свойства.
Кристаллическое строение металлов
Металлы — один из самых распространенных веществ в материальной культуре человека.
Тысячелетиями медь, железо, серебро и золото были основным материалом для производства оружия, инструментов, ответственных частей транспорта и механизмов, деталей домашней утвари и украшений.
В XIX веке, с освоением технологии получения чугуна, металлы пришли в строительство и станкостроение. XX век был веком металлов.
Металлы
В нашу жизнь вошли алюминий, титан, бор и многие более редкие металлы. Используя их, человечество шагнуло в небо, космос и глубины океана. Металлы сделали возможным массовое производство домашней бытовой техники.
В конце XX века пластмассы и композитные вещества ощутимо потеснили металлы с лидирующих позиций.
Основные характеристики металлов — прочность, упругость и пластичность определяются их физико-химическими свойствами и атомным строением.
Основные группы металлов в промышленности
Индустрия делит металлы на большие группы:
- Черные.
- Цветные легкие.
- Цветные тяжелые.
- Благородные.
- Редкоземельные и щелочные.
Черные металлы
В эту группу входят железо, марганец, хром и их сплавы. Группа также включает в себя стали, чугуны и ферросплавы. Эти вещества обладают хорошей электропроводностью и уникальными магнитными характеристиками.
Черные металлы
Черные металлы покрывают до 90% мировой потребности в металлоизделиях.
Легкие цветные металлы
Отличаются низкой плотностью. Группа включает в себя алюминий, титан, магний. Эти реже встречаются, чем железо, и обходятся дороже в добыче руды и в производстве. Они используются там, где малый вес изделия или детали окупает ее большую стоимость – в самолетостроении, производстве электроники, в коммуникационной индустрии.
Легкие цветные металлы
Титан не вызывает отторжения со стороны иммунной системы и применяется в протезировании костной ткани.
Тяжелые цветные металлы
Это элементы с большим удельным весом, такие, как медь, олово, свинец, цинк и никель. Обладают хорошей электропроводностью.
МедьОловоЦинкСвинец
Чистый никель
Они широко используются как катализаторы реакций, в изготовлении электроматериалов, в электронике, на транспорте – везде, где требуются достаточно прочные, упругие и коррозионностойкие материалы.
Благородные металлы
В эту группу входят золото, серебро, платина, а также редко встречающееся рутений, родий, палладий, осмий, иридий. Они обладают наибольшим удельным весом, высокой коррозионной устойчивостью и высокой электрической и тепловой проводимостью.
Золото и платинаСеребро
На заре человечества золото, серебро и платина применялись как универсальный платежный инструмент и как средство накопления богатств. С развитием цифровой экономики и переходом платежей в виртуальность важнее стаи их уникальные физические свойства
Редкоземельные и щелочные
К редкоземельным относятся скандий, иттрий, лантан и еще 15 редких элементов. Эти элементы отличаются значительным удельным весом, высокой химической активностью и применяются в высокотехнологичных отраслях.
ИттрийСканидийЛантан
К щелочным относятся литий, калий, натрий и другие. Все они отличаются малым удельным весом и исключительной химической активностью и при реакции с водой образуют щелочи, широко применяемы в быту и промышленности в составе мыла и других моющих средств.
Щелочные металлы
Классификация металлов по химическому составу
Химические свойства чистых элементов определяются строением атомов реальных металлов и прежде всего их атомным числом, характеризующим их способность реагировать с водородом, кислородом и другими элементами. Химические характеристики реально применяемых металлов могут сильно отличаться от параметров чистого вещества как в лучшую, так и в худшую сторону.
Нежелательные добавки называют примесями, а те, что вносятся преднамеренно для изменения параметров в нужную сторону — легирующими присадками.
Общепризнанной является классификация, основанная на указании главного компонента сплава.
Атомно — кристаллическое строение металлов
Внутреннее строение металлов и их характеристики определяют их физико-химические свойства. Электроны на внешних орбитах атомов слабо связаны с ядром и имеют отрицательный заряд. При наличии разницы потенциалов электроны мигрируют к положительному полюсу, создавая электрический ток. Это физическое явление обуславливает электропроводность.
Кристаллическое строение свойственно металлам и их сплавам в твердом фазовом состоянии. Атомы выстраиваются в определенную объемную структуру, называемую кристаллической решеткой.
Число атомов в вершинах и на гранях этой структуры, а также дистанция между ними определяют такие физические свойства металла, как электро- и теплопроводность, вязкость, текучесть и т.д.
Кристаллическое строение металлов и сплавов может быть двух типов:
- Межатомная дистанция одинакова по всем направлениям. Это так называемое изотропное строение. При этом физические свойства кристалла также одинаковы по всем направлениям.
- Межатомное расстояние по горизонтали и по вертикали разное. Такой кристалл называют анизотропным, и его физические параметры меняются в зависимости от направления.
Атомно-кристаллическое строение металлов
В реальном куске металлов, составленному из множества изолированных кристаллических фрагментов, атомно кристаллическое строение принадлежит к третьему типу — квазиизотропному. В среднем свойства такого куска близки к изотропным.
При выстраивании кристаллической решетки некоторые атомы не попадают на свое место, смещаются или теряются. В этом случае говорят о дефектах кристаллического строения металлов.
Дефекты структуры отрицательно влияют на свойства изделия, особенно если оно должно быть монокристаллом, как, например, в электронике, лазерной технике и других отраслях высоких технологий.
Физические свойства металлов
Физические свойства определяются внутренним строением металлов.
Главное отличие металлов от других элементов — это их электропроводность и магнитные свойства.
И хотя ученые создали неметаллические материалы, обладающие другим строением, но такими же свойствами, как у металлов и сплавов, они еще слишком дороги для массового применения. Многие химически чистые металлы обладают недостаточной прочностью для практических применений, чтобы исправить ситуацию, в технике и строительстве используют их сплавы.
Физические свойства металлов
Добавление тех или иных присадок приводит к росту прочность получаемого вещества в десятки раз по отношению к исходному элементу.
Электронное строение металлов и их особенности
Внутреннее строение реальных металлов определяет их физико-химические параметры.
Кристаллическая решетка металлов
Все металлы в твердом фазовом состоянии имеют кристаллическое строение. Это пространственное образование из многократно повторяющихся первичных структур называют кристаллической решеткой.
схема кристаллической решетки.
Кристаллическое строение металлов
Кристаллическое строение металлов и сплавов может быть двух типов:
- Межатомная дистанция равна по всем направлениям. Это так называемое изотропное строение. При этом физические свойства кристалла также одинаковы по всем направлениям.
- Межатомное расстояние по горизонтали и по вертикали разное. Такой кристалл называют анизотропным, его параметры зависят от направления.
В реальном куске металлов, который состоит из множества кристаллических фрагментов, атомно кристаллическое строение принадлежит к третьему типу — квазиизотропному. Усредненные параметры такого куска близки к изотропным.
Кристаллическое строение сплавов
Сплав это материал, состоящий из двух и более химических элементов. В его состав могут входить как металлы, так и неметаллы. Например, бронза — это сплав меди и олова, а чугун — сплав железа и углерода.
Кроме основных, в состав могут входить и другие вещества, содержащиеся в небольших количествах. Если их добавляют специально и улучшают свойства материала, их называют легирующими присадками, если ухудшают — вредными примесями.
Кристаллическое строение сплавов сложнее, чем металлов.
Строение сплавов
Оно определяется взаимовлиянием компонентов при образовании кристалла, и принадлежит к трем подвидам:
- Твердые растворы. Один элемент растворяется в другом. Ведущий элемент строит кристаллическую структуру, а атомы второстепенного элемента размещаются в объеме этой решетки.
- Химическое соединение. Элементы химически реагируют друг с другом, образуя новое соединение. Из его молекул и составляется кристаллическая решетка.
- Механическая смесь. Элементы сплава не реагируют друг с другом. Каждый строит свои кристаллические структуры, срастающиеся в независимые кристаллы. Сплав будет представлять собой затвердевшую смесь из множества кристалликов двух разных типов. Такое вещество будет иметь собственную температуру перехода в жидкую фазу.
Физические свойства сплавов могут заметно меняться при изменении процентного соотношения составляющих.
Кристаллизация сплавов
Первичная кристаллизация — это затвердевание расплава с образованием кристаллических решеток. Пространственные атомные и молекулярные структуры, возникающие в ходе такого процесса, оказывают решающее влияние на свойства получаемого сплава.
Сначала в остывающем расплаве возникают центры кристаллизации, вокруг них в ходе процесса и нарастают кристаллы, многократно повторяя структуру центра. В качестве центров кристаллизации могут выступать:
- Первые образовавшиеся кристаллы в зонах локального охлаждения, чаще всего у стенок литейной формы.
- Частички неметаллических примесей.
- Тугоплавкие примеси, уже находящиеся в твердой форме.
Процесс кристаллизации металлов и сплавов
Кристаллы обычно растут в направлении роста градиента температуры. Если рост решеток не встречает физических препятствий, образуются ветвящиеся кристаллические структуры, напоминающие кораллы — дендриты. Если они растут из разных центров и встречаются в расплаве, то препятствуют росту друг друга и искажают свою форму.
Такие искаженные кристаллы – это кристаллиты, или зерна. Совокупность отдельных зерен срастается в поликристаллическое тело.
Отдельные кристаллиты достигают размеров от одного до 10 000 микрон и по-разному развернуты в пространстве. На стыках отдельных кристаллитов образуется граничный слой, в котором кристаллические решетки разорваны.
Такие слои обладают измененными химическими и физическими свойствами.
Решетки кристаллитов могут обладать разными дефектами структуры:
- точечные;
- линейные;
- поверхностные;
Дефекты кристаллического строения металлов
Дефекты определяются отсутствием атома или группы атомов в вершинах или гранях кристаллической решетки, смещением этих атомов со своих мест или замещением атома или их группы атомами или молекулами примесей.
, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Кристаллическая структура меди
Медь, которая относиться к цветным металлам, известна с давних пор. Ее производство было изобретено раньше, чем люди начали изготавливать железо.
По предположениям активное ее использование произошло в результате ее доступности и достаточно простого извлечения из содержащих медь соединений и сплавов.
Итак, давайте рассмотрим сегодня свойства и состав меди, страны мира-лидеры по производству меди, изготовление изделий из нее и особенности этих сфер.
Медь обладает высоким коэффициентом электропроводимости, что послужило росту ее ценности, как электротехнического материала. Если ранее на электропровод тратилось до половины всей произведенной в мире меди, то сейчас с этими целями используется алюминий, как более доступный металл. А сама медь становиться наиболее дефицитным цветным металлом.
В этом видео рассмотрен химический состав меди:
Структурный состав меди включает в себя множество кристаллов: никель, золото, кальций, серебро, свинец и многие другие. Все металлы, входящие в ее структуру, отличаются относительной мягкостью, пластичностью и простотой обработки. Большинство таких кристаллов в сочетании с медью образуют твердые растворы с непрерывными рядами.
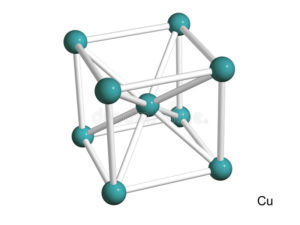
Элементарная ячейка данного металла представляет собой кубическую форму. На каждую такую ячейку приходится по четыре атома, располагающихся на вершинах и центральной части грани.
Производство меди
Медь производится из сульфидных руд, которые содержат эту медь в объеме минимум 0,5%. В природе существует около 40 минералов, содержащих данный металл. Наиболее распространенным сульфидным минералом, который активно используется в производстве меди, является халькопирит.
Для производства 1 т меди необходимо взять огромное количество сырья, которое ее содержит. Взять, к примеру, производство чугуна, для получения этого металла в объеме 1 тонны потребуется переработать около 2,5 т железной руды. А для получения такого же количества меди потребуется обработка до 200 т руды ее содержащей.
Далее рассмотрены способы производства меди и оборудование для этого.
ниже расскажет о добыче меди:
Производство меди включает в себя ряд этапов:
- Измельчение руды в специальных дробилках и последующее более тщательное ее измельчение в мельницах шарового типа.
- Флотация. Предварительно измельченное сырье смешивается с малым количеством флотореагента и затем помещается во флотационную машину. В качестве такого добавочного компонента обычно выступает ксантогенат калия и извести, который в камере машины покрывается минералами меди. Роль извести на этом этапе крайне важна, поскольку она предупреждает обволакивание ксантогената частичками других минералов. К медным частичкам прилипают лишь пузырьки воздуха, которые выносят ее на поверхность. В результате этого процесса получается медный концентрат, который направляется удаление из его состава избыточной влаги.
- Обжиг. Руды и их концентраты проходят процесс обжига в моноподовых печах, что необходимо для выведения из них серы. В результате получается огарок и серосодержащие газы, которые в дальнейшем используют для получения серной кислоты.
- Плавка шихты в печи отражательного типа. На этом этапе можно брать сырую или уже обожженную шихту и подвергать ее обжигу при температуре 1500°С. Важным условием работы является поддержанием нейтральной атмосферы в печи. В итоге происходит сульфидирование меди и ее преобразование в штейн.
- Конвертирование. Полученная медь в сочетании с кварцевым флюсом продувается в специальном конвекторе на протяжении 15-24 ч. В итоге получается черновая медь в результате полного выгорания серы и выведения газов. В ее состав может входить до 3% различных примесей, которые благодаря электролизу выводятся наружу.
- Рафинирование огнем. Металл предварительно расплавляется и затем рафинируется в специальных печах. На выходе образуется красная медь.
- Электролитическое рафинирование. Этот этап проходит анодная и огневая медь для максимальной очистки.
Про заводы и центры производства меди в России и в мире читайте ниже.
Медь
Самородная медь размером около 4 см
Медь — минерал из класса самородных элементов. В природном минерале обнаруживаются Fe, Ag, Au, As и другие элементы в виде примеси или образующие с Cu твёрдые растворы.
Простое вещество медь — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). Один из первых металлов, широко освоенных человеком из-за сравнительной доступности для получения из руды и малой температуры плавления.
Он входит в семёрку металлов, известных человеку с очень древних времён. Медь является необходимым элементом для всех высших растений и животных.
СТРУКТУРА
Кристаллическая структура меди
Кубическая сингония, гексаоктаэдрический вид симметрии m3m, кристаллическая структура — кубическая гранецентрированная решётка. Модель представляет собой куб из восьми атомов в углах и шести атомов , расположенных в центре граней (6 граней). Каждый атом данной кристаллической решетки имеет координационное число 12.
Самородная медь встречается в виде пластинок, губчатых и сплошных масс, нитевидных и проволочных агрегатов, а также кристаллов, сложных двойников, скелетных кристаллов и дендритов.
Поверхность часто покрыта плёнками «медной зелени» (малахит), «медной сини» (азурит), фосфатов меди и других продуктов её вторичного изменения.
СВОЙСТВА
Кристаллы самородной меди, Верхнее озеро, округ Кинави, Мичиган, США. Размер 12 х 8,5 см
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет.
Наряду с осмием, цезием и золотом, медь — один из четырёх металлов, имеющих явную цветовую окраску, отличную от серой или серебристой у прочих металлов.
Этот цветовой оттенок объясняется наличием электронных переходов между заполненной третьей и полупустой четвёртой атомными орбиталями: энергетическая разница между ними соответствует длине волны оранжевого света.Тот же механизм отвечает за характерный цвет золота.
Медь обладает высокой тепло- и электропроводностью (занимает второе место по электропроводности среди металлов после серебра). Удельная электропроводность при 20 °C: 55,5-58 МСм/м. Медь имеет относительно большой температурный коэффициент сопротивления: 0,4 %/°С и в широком диапазоне температур слабо зависит от температуры. Медь является диамагнетиком.
Существует ряд сплавов меди: латуни — с цинком, бронзы — с оловом и другими элементами, мельхиор — с никелем и другие.
Запасы и добыча
Образец меди, 13,6 см. Полуостров Кинави, Мичиган, США
Среднее содержание меди в земной коре (кларк) — (4,7-5,5)·10−3% (по массе). В морской и речной воде содержание меди гораздо меньше: 3·10−7% и 10−7% (по массе) соответственно. Большая часть медной руды добывается открытым способом. меди в руде составляет от 0,3 до 1,0 %.
Мировые запасы в 2000 году составляли, по оценке экспертов, 954 млн т, из них 687 млн т — подтверждённые запасы, на долю России приходилось 3,2 % общих и 3,1 % подтверждённых мировых запасов. Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет.
Медь получают из медных руд и минералов.
Основные методы получения меди — пирометаллургия, гидрометаллургия и электролиз. Пирометаллургический метод заключается в получении меди из сульфидных руд, например, халькопирита CuFeS2.
Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте или в растворе аммиака; из полученных растворов медь вытесняют металлическим железом.
ПРОИСХОЖДЕНИЕ
Небольшой самородок меди
Обычно самородная медь образуется в зоне окисления некоторых медносульфидных месторождений в ассоциации с кальцитом, самородным серебром, купритом, малахитом, азуритом, брошантитом и другими минералами. Массы отдельных скоплений самородной меди достигают 400 тонн.
Крупные промышленные месторождения самородной меди вместе с другими медьсодержащими минералами формируются при воздействии на вулканические породы (диабазы, мелафиры) гидротермальных растворов, вулканических паров и газов, обогащенных летучими соединениями меди (например, месторождение озера Верхнее, США).
Самородная медь встречается также в осадочных породах, преимущественно в медистых песчаниках и сланцах.
Наиболее известные месторождения самородной меди — Туринские рудники (Урал), Джезказганское (Казахстан), в США (на полуострове Кивино, в штатах Аризона и Юта).Интересное о меди
Изначально процесс восстановления этого металла выглядел очень примитивно: медную руду просто нагревали на кострах, а затем подвергали резкому охлаждению, что приводило к растрескиванию кусков руды, из которых уже можно было извлекать медь.
Дальнейшее развитие такой технологии привело к тому, что в костры начали вдувать воздух: это повышало температуру нагревания руды. Затем нагрев руды стали выполнять в специальных конструкциях, которые и стали первыми прототипами шахтных печей.
О том, что медь используется человечеством с древних времен, свидетельствуют археологические находки, в результате которых были найдены изделия из данного металла.
Историками установлено, что первые изделия из меди появились уже в 10 тысячелетии до н.э, а наиболее активно она стала добываться, перерабатываться и использоваться спустя 8–10 тысяч лет.
Естественно, предпосылками к такому активному использованию данного металла стали не только относительная простота его получения из руды, но и его уникальные свойства: удельный вес, плотность, магнитные свойства, электрическая, а также удельная проводимость и др.
В наше время уже сложно найти медь в природе в виде самородков, обычно ее добывают из руды, которая подразделяется на следующие виды.
- Борнит — в такой руде медь может содержаться в количестве до 65%.
- Халькозин, который также называют медным блеском. В такой руде меди может содержаться до 80%.
- Медный колчедан, также называемый халькопиритом (содержание до 30%).
- Ковеллин (содержание до 64%).
Халькопирит
Медь также можно извлекать из множества других минералов (малахит, куприт и др.). В них она содержится в разных количествах.
Области применения меди
Применение меди, как и наиболее схожего с ней по своим свойствам алюминия, хорошо известно — это производство кабельной продукции.
Медные провода и кабели, характеризуются невысоким электрическим сопротивлением и особыми магнитными свойствами.
Для производства кабельной продукции применяются виды меди, характеризующиеся высокой чистотой.
Если в ее состав добавить даже незначительное количество посторонних металлических примесей, к примеру, всего 0,02% алюминия, то электрическая проводимость исходного металла уменьшится на 8–10%.
Невысокий вес меди и ее высокая прочность, а также способность поддаваться различным видам механической обработки — это те свойства, которые позволяют производить из нее трубы, успешно использующиеся для транспортировки газа, горячей и холодной воды, пара. Совершенно не случайно именно подобные трубы применяются в составе инженерных коммуникаций жилых и административных зданий в большинстве европейских стран.