Переходные металлы список
Переходные металлы
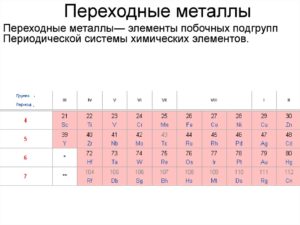
Перехо́дные мета́ллы(перехо́дные элеме́нты) — элементы побочных подгрупп Периодической системы химических элементов Д. И. Менделеева, в атомах которых появляются электроны на d- и f-орбиталях.
[1] В общем виде электронное строение переходных элементов можно представить следующим образом: . На ns-орбитали содержится один или два электрона, остальные валентные электроны находятся на -орбитали.
Поскольку число валентных электронов заметно меньше числа орбиталей, то простые вещества, образованные переходными элементами, являются металлами.
Общая характеристика переходных элементов
Все переходные элементы имеют следующие общие свойства: [2]
- Для всех переходных элементов характерно образование комплексных соединений.
Подгруппа меди
Подгруппа меди, или побочная подгруппа I группы Периодической системы химических элементов Д. И. Менделеева, включает в себя элементы: медь Cu, серебро Ag и золото Au.
Свойства металлов подгруппы меди [3]
| 29 | Медь Cu | [Ar] 3d104s1 | 0, +1, +2 | 8,96 [4][5] | 1083 [4][5] | 2543 [4][5] |
| 47 | Серебро Ag | [Kr] 4d105s1 | 0, +1, +3 | 10,5 [6] | 960,8 [6] | 2167 [6] |
| 79 | Золото Au | [Xe] 4f145d106s1 | 0, +1, +3 | 19,3 [7] | 1063,4 [7] | 2880 [7] |
Для всех металлов характерны высокие значения плотности, температур плавления и кипения, высокая тепло- и электропроводность. [8]
Особенностью элементов подгруппы меди является наличие заполненного предвнешнего -подуровня, достигаемое за счёт перескока электрона с ns-подуровня.
Причина такого явления заключается в высокой устойчивости полностью заполненного d-подуровня.Эта особенность обусловливает химическую инертность простых веществ, их химическую неактивность, поэтому золото и серебро называют благородными металлами.[9]
Медь
Основная статья: Медь
Металлическая медь в стеклянной пробирке
Медь представляет собой довольно мягкий металл красно-жёлтого цвета [10]. В электрохимическом ряду напряжений металлов она стоит правее водорода, поэтому растворяется только в кислотах-окислителях (в азотной кислоте любой концентрации и в концентрированной серной кислоте):
В отличие от серебра и золота, медь окисляется с поверхности кислородом воздуха уже при комнатной температуре. В присутствии углекислого газа и паров воды её поверхность покрывается зелёным налётом, представляющим собой основной карбонат меди(II).
Для меди наиболее характерна степень окисления +2 [11], однако существует целый ряд соединений, в которых она проявляет степень окисления +1.
Оксид меди(II)
Основная статья: Оксид меди(II)
Оксид меди(II) в порошкообразной форме
Оксид меди(II) CuO — вещество чёрного цвета. Под действием восстановителей при нагревании он превращается в металлическую медь:
Растворы всех солей двухвалентной меди окрашены в голубой цвет, который им придают гидратированные ионы .
При действии на растворимые соли меди раствором питьевой соды образуется малорастворимый основной карбонат меди (II) — малахит:
Гидроксид меди(II)
Основная статья: Гидроксид меди(II)
Свежеосаждённый гидроксид меди(II)
Гидроксид меди(II) Cu(OH)2 образуется при действии щелочей на растворимые соли меди(II) [12]:
Это малорастворимое в воде вещество голубого цвета. Гидроксид меди(II) — амфотерный гидроксид с преобладанием основных свойств. При сильном нагревании или стоянии под маточным раствором он разлагается:
При добавлении аммиака Cu(OH)2 растворяется с образованием ярко-синего комплекса:
Соединения одновалентной меди
Соединения одновалентной меди крайне неустойчивы, поскольку медь стремится перейти либо в Cu2+, либо в Cu0. Стабильными являются нерастворимые соединения CuCl, CuCN, Cu2S и комплексы типа . [13]
Серебро
Основная статья: Серебро
Металлическое серебро в стеклянной пробирке
Серебро более инертно, чем медь[14] , но при хранении на воздухе оно чернеет из-за образования сульфида серебра:
Серебро растворяется в кислотах-окислителях:
Наиболее устойчивая степень окисления серебра +1. В аналитической химии широкое применение находит растворимый нитрат серебра AgNO3, который используют как реактив для качественного определения ионов Cl−, Br−, I−:
При добавлении к раствору AgNO3 раствора щёлочи образуется тёмно-коричневый осадок оксида серебра Ag2O:
Многие малорастворимые соединения серебра растворяются в веществах-комплексообразователях, например, аммиаке и тиосульфате натрия:
Золото
Основная статья: Золото
Золото представляет собой металл, сочетающий высокую химическую инертность и красивый внешний вид, что делает его незаменимым в производстве ювелирных украшений. [15] В отличие от меди и серебра, золото крайне инертно по отношению к кислороду и сере, но реагирует с галогенами при нагревании:
Чтобы перевести золото в раствор, необходим сильный окислитель, поэтому золото растворимо в смеси концентрированных соляной и азотной кислот («царской водке»):
Платиновые металлы
Основная статья: Металлы платиновой группы
Платиновые металлы — семейство из 6 химических элементов побочной подгруппы VIII группы Периодической системы, включающее рутений Ru, родий Rh, палладий Pd, осмий Os, иридий Ir и платину Pt. Эти металлы подразделяются на две триады: лёгкие — триада палладия (Ru, Rh, Pd) и тяжёлые — триада платины (Os, Ir, Pt).
Литература
- Ахметов Н. С. Общая и неорганическая химия. — М.: Высшая школа, 2001.
- Ерёмина Е. А., Рыжова О. Н. Глава 17. Переходные элементы // Справочник школьника по химии. — М.: Экзамен, 2009. — С. 250-275. — 512 с. — 5000 экз. — ISBN 978-5-377-01472-0
- Кузьменко Н. Е. , Ерёмин В. В., Попков В. А. Начала химии. Современный курс для поступающих в вузы. — М.: Экзамен, 1997-2001.
- Лидин Р. А., Андреева Л. Л., Молочко В. А. Справочник по неорганической химии. — М.: Химия, 1987.
- Некрасов Б. В. Основы общей химии. — М.: Химия, 1974.
- Рабинович В. А., Хавин З. Я. Краткий химический справочник. — Л., 1977. — С. 98.
- Спицын В. И., Мартыненко Л. И. Неорганическая химия. — М.: МГУ, 1991, 1994.
- Турова Н. Я. Неорганическая химия в таблицах. Учебное пособие. — М.: Высший химический колледж РАН, 1997.
См. также
- Благородные металлы
- Металлы
- Щелочные металлы
- Щёлочноземельные металлы
Ссылки
Сообщение про цинк

Что такое цинк, люди знали еще до нашей эры. Ведь именно тогда научились применять сплавы, содержащие этот металл. Египтяне использовали руды, содержащие медь и цинк, сплавляли их и получали очень прочный, устойчивый к окислению материал. Были найдены предметы быта, посуда, выполненные из этого материала.
Название zinc встречается в трудах врача Парацельса в XVI веке нашей эры. В этот же период металл активно начинают использовать китайцы, отливая из него монеты. Постепенно знания об этом веществе и его хороших технических свойствах переходят в Европу. Тогда и в Германии, Англии также узнали, что такое цинк и где его можно использовать.
https://www..com/watch?v=https:accounts.google.comServiceLogin
Латунь была одним из первых и самых известных сплавов, используемых еще с древних веков на Кипре, а позже в Германии и других странах.
Название происходит от латинского zincum, однако этимология не совсем ясна. Есть несколько версий.
- От немецкого zinke, что переводится как «острие».
- От латинского zincum, что означает «белый налет».
- Персидский «ченг», то есть камень.
- Древнегерманский zinco, что переводится, как «налет», «бельмо на глазу».
Сегодняшнее название элемент получил только в начале XX века. О значении ионов цинка в организме человека также стало известно лишь сравнительно недавно (XX век). До этого никакие недуги с этим элементом не связывали.
Однако известно, что уже в древности многие народы использовали супы из мяса молодого барашка как средство восстановления после болезни и для скорейшей поправки. Сегодня можно сказать, что эффект достигался за счет ионов цинка, которых в этом блюде содержится достаточно много. Он помогал восстановлению кровообращения, снятию усталости и активизировал мозговую деятельность.
Данный элемент располагается в периодической системе во второй группе, побочной подгруппе. Порядковый номер 30, масса Цинка — 65,37. Единственная и постоянная степень окисления 2. Электронная конфигурация внешнего слоя атома 4s2.
В таблице Цинк, Медь, Кадмий, Хром, Марганец и многие другие — это переходные металлы. К ним относятся все те, у которых электроны заполняют внешний и предвнешний d и f энергетические подуровни.Переходные металлы включают в себя и группу платиновых (Золото, Иридий, Палладий, Платина, Осмий и другие). Для всех них характерно образование комплексных соединений, в которых они выступают в качестве комплексообразователя с разными координационными числами. Все это характерно и для рассматриваемого нами элемента.
Существует 5 устойчивых в природе изотопов с массовыми числами от 64 до 70. 65Zn — радиоактивный, с периодом полураспада 244 дня.
Цинк как простое вещество
Что такое цинк в обычном виде? Это — металл, серебристо-голубой, быстро покрывающийся защитной оксидной пленкой на воздухе. Из-за этого кажется, что он не очень блестящий. Однако стоит пленку удалить, как цинк проявляет свойства всех металлов — красивый характерный блеск и сияние.
В природе содержится в составе многих минералов и руд. Так, самыми распространенными из них являются:
- цинковая обманка, или сфалерит;
- клейофан;
- марматит;
- вюртцит;
- смитсонит;
- каламин;
- цинкит;
- виллемит;
- франкленит и другие.
В составе смешанных руд Цинк обычно встречается вместе со своими постоянными спутниками, такими как:
- Таллий;
- Германий;
- Индий;
- Галлий;
- Кадмий.
Всего в земной коре на долю этого металла приходится 0,076%. Это чуть больше, чем на медь. Также 0,07 мг/л этого вещества содержится в морской воде.
Формула цинка как простого вещества — Zn. Кристаллическая решетка гексагональная, плотная. Тип химической связи — металлическая.
Химические свойства
Можно обозначить несколько характеристик.
- Цвет — сребристо-голубой.
- Плотность — 7,13 г/см3.
- Температура плавления — 420 оС (относится к группе легкоплавких металлов).
- При обычных условиях — хрупкое вещество.
- Температура кипения — 906 оС.
- При нагревании до 100-150 оС повышается ковкость и пластичность, возможно изготовление проволоки и прокатка в фольгу.
- Свыше 200 оС легко растирается в серый порошок, теряя пластичность.
- Является отличным проводником.
- Теплопроводность хорошая, так же как и теплоемкость.
Такие физические параметры позволяют использовать металл в соединениях с другими элементами. Например, широко известен сплав цинка — латунь.
При обычных условиях поверхность куска металла мгновенно покрывается серо-белым тусклым налетом — оксидом цинка. Это происходит от того, что кислород воздуха мгновенно окисляет чистое вещество.
Если же долгое время хранить чистый металл на открытом влажном воздухе, то произойдет его разрушение под действием углекислого газа. Как простое вещество цинк реагирует с:
- галогенами;
- халькогенами;
- кислородом;
- кислотами;
- щелочами;
- аммиаком и аммонием (его солями);
- более слабыми металлами.
https://www..com/watch?v=ytpolicyandsafetyru
Не вступает в реакции с азотом. Если же взять химически абсолютно чистый цинк, то он не реагирует ни с чем из перечисленных веществ.
Очевидно, что цинк — металл амфотерный. При реакциях со щелочами образует комплексные соединения — гидроксоцинкаты.
Соединения цинка
Таковых можно назвать несколько основных категорий:
- Силицид цинка.
- Карбид тройного вида — Ni3ZnC.
- Галогениды цинка (хлорид, фторид, йодид, бромид).
- Сульфид, селенид, арсенид цинка.
- Фосфид и борид.
- Аммиакатные комплексы, формирующиеся при взаимодействии металла с раствором аммиака.
- Цианиды, тиосульфаты и тиоцианаты существуют в виде соответствующих комплексов в водном растворе.
- Оксид и гидроксид цинка — амфотерные соединения, используемые для получения комплексов гидроксоцинкатов.
Большинство соединений рассматриваемого элемента используются в химической промышленности или других отраслях (технике, бытовых синтезах, лакокрасочной промышленности).
Оксид цинка находит широкое применение в медицине. Он обладает хорошим противовоспалительным действием, слегка подсушивает и убивает бактерии. Поэтому его используют в косметических средствах для лечения прыщей, камедонов, угрей и других заболеваний кожи.
Соли цинка
Практически все соли, которые не являются двойными и комплексными, то есть не содержат посторонних окрашенных ионов, — это бесцветные кристаллические вещества. Самыми популярными в плане использования человеком являются следующие из них.
- Хлорид цинка — ZnCL2. Другое название соединения — паяльная кислота. Внешне представляет собой белые кристаллики, хорошо впитывающие влагу воздуха. Используется для очищения поверхности металлов перед пайкой, получения фибры, в батарейках, для пропитки дерева перед обработкой в качестве дезинфектора.
- Сульфид цинка. Белый порошок, быстро желтеющий при нагревании. Имеет высокую температуру плавления, в отличие от чистого металла. Используется при производстве люминесцирующих составов, наносимых на экраны, панели и прочие предметы. Является полупроводником.
- Фосфид цинка — распространенная отрава, применяемая для избавления от грызущих животных (мышей, крыс).
- Смитсонит, или карбонат цинка — ZnCO3. Бесцветное кристаллическое соединение, нерастворимое в воде. Применяется в нефтехимическом производстве, а также в реакциях получения шелка. Является катализатором в органических синтезах, используется в качестве удобрения для почв.
- Ацетат цинка — (CH3COO)2Zn. Бесцветные кристаллы, хорошо растворимые во всех растворителях любой природы. Находит широкое применение как в химической, так и в медицинской и пищевой промышленности. Используется для лечения нозафарингита. Применяется в качестве пищевой добавки Е650 — освежает дыхание, предупреждает появление налета на зубах, когда входит в состав жвачки. Его же используют для протравливания красителей, консервации древесины, производства пластмасс и прочих органических синтезах. Практически везде играет роль ингибитора.
- Йодид цинка — белые кристаллы, используемые в рентгенографии, в качестве электролита в аккумуляторах, как краситель для электронных микроисследований.
- Черные или темно-зеленые кристаллы, которые невозможно получить прямым синтезом, так как цинк с азотом не реагирует. Образуются из аммиаката металла. При высоких температурах разлагается с высвобождением цинка, поэтому применяется для его получения.
- Нитрат цинка. Бесцветные гигроскопичные кристаллы. Применение цинка в таком виде осуществляется в текстильной и кожевенной промышленностях для протравки тканей.
Сплавы цинка
Как уже упоминалось выше, существует самый распространенный сплав цинка — латунь. Именно он известен с самой древности и активно используется людьми до сих пор. Что же он собой представляет?
Латунь — это медь и цинк, которые гармонично сочетаются с несколькими другими металлами, придающими дополнительный блеск, прочность и тугоплавкость сплаву. Цинк в составе как легирующий элемент, медь — как основной.
Цвет материала желтый, блестящий, однако на открытом воздухе во влажной среде способен чернеть.
Температура плавления около 950 оС, может варьироваться в зависимости от содержания цинка (чем больше его, тем температура ниже).
Материал хорошо прокатывается в листы, трубы, сваривается контактным способом. Имеет хорошие технические характеристики, поэтому из него изготавливаются следующие элементы:.
- Детали машин и различные технические приборы.
- Гильзы и штампованные изделия.
- Гайки, болты, патрубки.
- Арматуры, втулки, антикоррозийные детали разных видов транспорта.
- Детали часов.
Большая часть добываемого в мире рассматриваемого нами металла уходит именно на изготовление данного сплава.
Еще один вид интерметаллического соединения — антимонид цинка. Формула его Zn4Sb3. Это также сплав, который используется как полупроводник в транзисторах, тепловизорах, магниторезистивных устройствах.
Очевидно, что применение цинка и его соединений очень широко и практически повсеместно. Данный металл так же популярен, как медь и алюминий, серебро и золото, марганец и железо. Особенно велико его значение в технических целях как антикоррозионного материала. Ведь именно цинком покрываются разные сплавы и изделия для защиты от этого разрушающего природного процесса.
Биологическая роль
https://www..com/watch?v=ytadvertiseru
Что такое цинк с точки зрения медицины и биологии? Имеет ли он значение для жизни организмов и насколько оно велико? Оказывается, ионы цинка просто обязательно должны присутствовать в живых существах. Иначе дефицит приведет к следующим последствиям:
- анемии;
- снижению инсулина;
- аллергии;
- потере веса и памяти;
- утомляемости;
- депрессии;
- ухудшению зрения;
- раздражительности и другим.
Основные места концентрации ионов цинка в организме человека — это поджелудочная железа, печень и мышцы. Также именно этот металл входит в состав большинства ферментов (например, карбоангидраза). Поэтому большинство реакций катализа происходит при участии цинка.
Что именно делают ионы?
- Участвуют в синтезе мужских гормонов и семенной жидкости.
- Способствуют усвоению витамина Е.
- Участвуют в расщеплении молекул алкоголя в организме.
- Являются непосредственными участниками синтеза многих гормонов (инсулина, гормона роста, тестостерона и других).
- Принимает участие в кроветворении и заживлении поврежденных тканей.
- Регулирует секрецию сальных желез, поддерживает нормальный рост волос и ногтей, способствует регенерационным процессам в коже.
- Обладает способностью устранять из организма токсины и укреплять иммунитет.
- Влияет на формирование вкусовых ощущений, а также обоняния.
- Принимает участие в процессах транскрипции, обмене витамина А, нуклеиновых синтезах и распадах.
- Является участником всех стадий роста и развития клетки, а также сопровождает процесс экспрессии гена.
Все это еще раз доказывает, насколько важным элементом является данный металл. Роль его в биологических системах была выяснена только в XX веке. Многих неприятностей и недугов в прошлом можно было бы избежать, если бы люди знали о лечении при помощи препаратов на основе цинка.
Каким же образом можно поддерживать нужное количество этого элемента в организме? Ответ очевиден. Необходимо употреблять продукты, содержащие цинк. Список может быть длинным, поэтому укажем только те, в которых максимальное количество рассматриваемого элемента:
- орехи и семечки;
- бобовые;
- мясо;
- морепродукты, особенно, устрицы;
- злаки и хлеб;
- молочная продукция;
- зелень, овощи и фрукты.
Использование человеком
Мы уже в целом обозначали, в каких отраслях и областях промышленности используется цинк. Цена на этот металл и его сплавы достаточно высока. Например, лист латуни размером 0,6 х 1,5 приблизительно оценивают в 260 рублей. И это вполне оправданно, ведь качество материала достаточно высокое.
Итак, металлический цинк, то есть как простое вещество, используется:
- для покрытия против коррозии на железных и стальных изделиях;
- в аккумуляторах;
- типографии;
- в качестве восстановителя и катализатора в органических синтезах;
- в металлургии для выделения других металлов из их растворов.
Оксид цинка используется не только в косметических целях, о которых мы уже упоминали, но и в качестве наполнителя при производстве резины, как белый пигмент в красках.
https://www..com/watch?v=ytcreatorsru
О том, где используются различные соли цинка, мы говорили при рассмотрении этих соединений. Очевидно, что в целом цинк и его вещества — это важные и значимые в промышленности, медицине и других отраслях компоненты, без которых многие процессы оказались бы невозможными или сильно затрудненными.
Переходные металлы список — Справочник металлиста

У всех металлов есть общие физические свойства, например блеск и электропроводность, однако в зависимости от химических свойств они делятся на несколько групп.
Такие металлы, как калий и натрий, очень активны и мгновенно вступают в реакции с водой и воздухом, в то время как золото вообще не вступает в реакции. На рисунке изображена золотая маска царя Микен (см.
статью «Загадочные жители Греции»)
Свойства металлов
При комнатной температуре (20 °С) все металлы, кроме ртути, пребывают в твердом состоянии и хорошо проводят тепло и электричество. На срезе металлы блестят и некоторые, как железо и никель, обладают магнитными свойствами. Многие металлы пластичны — из них можно делать проволоку — и ковки — им несложно придать другую форму.
Благородные металлы
Благородные металлы в земной коре встречаются в чистом виде, а не в составе соединений. К ним относятся медь, серебро, золото и платина. Они химически пассивны и с трудом вступают в химические реакции с другими элементами.
Медь — благородный металл. Золото — один из самых инертных элементов. Из-за своей инертности благородные металлы не подвержены коррозии, поэтому из них делают украшения и монеты.
Золото настолько инертно, что древние золотые изделия до сих пор ярко сияют.
Щелочные металлы
Группу 1 в периодической таблице составляют 6 очень активных металлов, в т.ч. натрий и калий.
Они плавятся при сравнительно низкой температуре (температура плавления калия 64 °С) и настолько мягкие, что их можно резать ножом.
Вступая в реакцию с водой, эти металлы образуют щелочной раствор и поэтому называются щелочными. Калий бурно реагирует с водой. При этом выделяется водород, который сгорает сиреневым пламенем.
Щелочноземельные металлы
Шесть металлов, составляющих 2-ю группу периодической таблицы (в т.ч. магний и кальций), называются щелочноземельными. Эти металлы входят в состав множества минералов.
Так, кальций имеется в кальците, прожилки которого можно обнаружить в известняке и меле. Щелочноземельные металлы менее активны, чем щелочные, они тверже и плавятся при более высокой температуре. Кальций содержится в ракушках, костях и губках.
Магний входит в состав хлорофилла, зеленого пигмента, необходимого для фотосинтеза.
Металлы 3-й и 4-й групп
Семь металлов этих групп расположены в периодической таблице справа от переходных металлов. Алюминий — один из наименее плотных металлов, поэтому он легкий.
А вот свинец очень плотный; из него делают экраны, защищающие от рентгеновских лучей. Все эти металлы довольно мягкие и плавятся при относительно низкой температуре.
Многие из них используются в сплавах — создаваемых с определенными целями смесях металлов. Велосипеды и самолеты делают из алюминиевых сплавов.
Переходные металлы
Переходные металлы обладают типично металлическими свойствами. Они прочные, твердые, блестящие и плавятся при высоких температурах. Они менее активны, чем щелочные и щелочноземельные металлы. К ним относятся железо, золото, серебро, хром, никель, медь.
Они все ковкие и широко применяются в промышленности — как в чистом виде, так и в виде сплавов. Около 77% от массы автомобиля составляют металлы, в основном сталь, т.е. сплав железа и углерода (см. статью «Железо, сталь и прочие металлы«). Ступицы колес делают из хромированной стали — для блеска и предохранения от коррозии.
Корпус машины сделан из листовой стали. Стальные бамперы предохраняют автомобиль в случае столкновения.
Ряд активности
Положение металла в ряду активности показывает, насколько охотно металл вступает в реакции. Чем более активен металл, тем легче он отнимает кислород у менее активных металлов.
Активные металлы трудно выделить из соединений, тогда как малоактивные металлы встречаются в чистом виде. Калий и натрий хранят в керосине, так как они моментально вступают в реакции с водой и воздухом. Медь – наименее активный металл из числа недорогих.
Она используется в производстве труб, резервуаров для горячей воды и электрических проводов.
Металлы и пламя
Некоторые металлы, если поднести их к огню, придают пламени определенный оттенок. По цвету пламени можно определить присутствие в соединении того или иного металла. Для этого крупинку вещества помешают в пламя на конце проволоки из инертной платины.
Соединении натрия окрашивают пламя в желтый цвет, соединения меди — в сине-зеленый, соединении кальции — в красный, и калия — в сиреневый. В состав фейерверков входят разные металлы, сообщающие пламени разные оттенки.
Барий дает зеленый цвет, стронций — красный, натрий — желтый, а медь — сине-зеленый.
Коррозия
Коррозия — это химическая реакция, происходящая при контакте металла с воздухом или водой. Металл взаимодействует с кислородом воздуха, и на его поверхности образуется оксид. Металл теряет блеск и покрывается налетом.
Высокоактивные металлы подвергаются коррозии быстрее, чем менее активные. Рыцари смазывали стальные доспехи маслом или воском, чтобы они не ржавели (сталь содержит много железа).
Для предохранения от ржавчины стальной корпус автомобиля покрывают несколькими слоями краски.
Некоторые металлы (например, алюминий) покрываются защищающей их плотной оксидной пленкой. Железо при коррозии образует неплотную пленку оксида, которая при реакции с водой дает ржавчину.Слой ржавчины легко осыпается, и процесс коррозии распространяется вглубь. Для предохранения от коррозии стальные консервные банки покрывают слоем олова — менее активного металла.
Крупные сооружения, например мосты, спасает от коррозии краска.
Переходный металл: свойства и список

Элементы в периодической таблице часто делятся на четыре категории: элементы основной группы, переходные металлы, лантаноиды и актиноиды.
В основные элементы группы включают активные металлы в двух колонках по крайней левой части таблицы Менделеева и металлов, полуметаллов и неметаллов в шести колонках на крайней правой.
Эти переходные металлы являются металлическими элементами, которые выступают в качестве своего рода моста или перехода между частями сторонами периодической таблицы.
Что это такое
Эвентуальный — это какой?
Из всех групп химических элементов переходные металлы могут быть наиболее сложными для идентификации, потому что существуют различные мнения относительно того, что именно туда должно быть включено.
Согласно одному из определений, к ним относят любые вещества с частично заполненной d-электронной подоболочкой (обиталью).
Это описание относится к группам с 3-й по 12-ю в периодической таблице, хотя элементы f-блока (лантаноиды и актиноиды, расположенные ниже основной части периодической таблицы) также являются переходными металлами.
Их название связано с именем английского химика Чарльза Бери, который использовал его в 1921 году.
Место в периодической таблице
Переходными являются все металлы рядов, расположенных в группах от IB до VIIIB периодической таблицы:
- с 21-го (скандий) по 29-й (медь);
- с 39-го (иттрий) по 47-й (серебро);
- с 57-го (лантан) до 79-го (золото);
- с 89-го (актиний) до 112-й (коперник).
Последняя группа включает лантаноиды и актиноиды(так называемые f-элементы, которые представляют собой их особую группу, все остальные относятся к d-элементам).
Переходные металлы: список
Перечень этих элементов представлен:
- скандием;
- титаном;
- ванадием;
- хромом;
- марганцем;
- железом;
- кобальтом;
- никелем;
- медью;
- цинком;
- иттрием;
- цирконием;
- ниобием;
- молибденом;
- технецием;
- рутением;
- родием;
- палладием;
- серебром;
- кадмием;
- гафнием;
- танталом;
- вольфрамом;
- рением;
- осмием;
- иридием;
- платиной;
- золотом;
- ртутью;
- резерфодием;
- дубнием;
- сиборгием;
- борием;
- хассием;
- мейтнерием;
- дармштадтием;
- рентгением;
- унунбием.
Группа лантаноидов представлена:
- лантаном;
- церием;
- празеодимом;
- неодимом;
- прометием;
- самарием;
- европием;
- гадолинием;
- тербием;
- диспрозием;
- гольмием;
- эрбием;
- тулием;
- иттербием;
- лютецием.
Актиноиды представлены:
- актинием;
- торием;
- протактинием;
- ураном;
- нептунием;
- плутонием;
- америцием;
- кюрием;
- берклием;
- калифорнием;
- эйнштейнием;
- фермием;
- менделевием;
- нобелием;
- лоуренсием.
Особенности
В процессе образования соединений атомы металлов могут использоваться как валентные s- и p-электроны, так и d-электроны. Поэтому d-элементы в большинстве случаев характеризуются переменной валентностью, в отличие от элементов главных подгрупп. Это свойство обуславливает их способность к образованию комплексных соединений.
Наличие определенных свойств обуславливает название этих элементов. Все переходные металлы ряда являются твердыми с высокими температурами плавления и кипения.
При перемещении слева направо по периодической таблице пять d-орбиталей становятся более заполненными. Их электроны слабо связаны, что способствует высокой электропроводности и податливости переходных элементов.
Им свойственна также низкая энергия ионизации (она требуется при удалении электрона от свободного атома).
Проблемы систематизации
Разногласия относительно того, следует ли классифицировать их как относящиеся к основной группе или переходные металлы, свидетельствуют о том, что различия между этими категориями не ясны.
Между ними есть определенное сходство: они выглядят как металлы, они податливы и пластичны, они проводят тепло и электричество и образуют положительные ионы.
Тот факт, что двумя лучшими проводниками электричества являются переходный металл (медь) и элемент, относящийся к основной группе (алюминий), показывает степень, в которой физические свойства элементов двух этих групп перекрываются.
Сравнительная характеристика
Существуют также различия между основными и переходными металлами. Например, последние являются более электроотрицательными, чем представители основной группы. Поэтому они с большей вероятностью образуют ковалентные соединения.
Другое различие между металлами основной группы и переходными металлами можно увидеть в формулах соединений, которые они образуют.
Первые имеют тенденцию образовывать соли (такие как NaCl, Mg 3 N 2 и CaS), в которых достаточно только отрицательных ионов, чтобы уравновесить заряд на положительных ионах. Переходные металлы образуют аналогичные соединения, такие как FeCl3, HgI2 или Cd (OH)2.Однако они чаще, чем металлы основной группы, образуют комплексы, такие как FeCl4- , HgI42- и Cd (ОН)42-, имеющие избыточное количество отрицательных ионов.
Еще одно отличие между основной группой и ионами переходных металлов заключается в легкости, с которой они образуют стабильные соединения с нейтральными молекулами, такими как вода или аммиак.
Источник