Все металлы в таблице менделеева
Таблица химических элементов Менделеева, металлы, неметаллы

Таблица Менделеева является одним из главных постулатов химии. С ее помощью можно найти все необходимые элементы, как щелочные, так и обычные металлы или неметаллы. В этой статье мы рассмотрим, как в такой таблице отыскать необходимые вам элементы.
Историческая справка
В середине 19 века было открыто 63 химических элемента. Первоначально предполагалось разместить элементы согласно увеличению атомной массы и поделить их на группы. Однако структурировать их не удавалось, а предложение химика Нуланда не было воспринято всерьез из-за попыток связать между собой химию и музыку.
В 1869 году Дмитрий Иванович Менделеев впервые опубликовал свою периодическую таблицу на страницах журнала Русского химического общества. Вскоре он известил о своем открытии химиков по всему миру.
Менделеев впоследствии продолжал дорабатывать и улучшать свою таблицу, пока она не приобрела современный вид. Именно Менделеев сумел расставить химические элементы таким образом, чтобы они изменялись не монотонно, а периодически.
Окончательно теория объединилась в периодический закон в 1871 году. Перейдем к рассмотрению неметаллов и металлов в таблице Менделеева.
Определение металлов теоретическим методом
Теоретический метод:
- Все металлы, за исключением ртути, находятся в твердом агрегатном состоянии. Они пластичны и без проблем гнутся. Также данные элементы отличаются хорошими тепло- и электропроводящими свойствами.
- Если вам нужно определить список металлов, то проведите диагональную линию от бора до астата, ниже которой будут располагаться металлические компоненты. К ним относятся также все элементы побочных химических групп.
- В первой группе первой подгруппе находятся щелочные, например, литий или цезий. При растворении образую щелочи, а именно гидроксиды. Обладают электронной конфигурацией вида ns1 с одним валентным электроном, который при отдаче приводит проявлению восстановительных свойств.
Во второй группе главной подгруппы находятся щелочно-земельные металлы по типу радия или кальция. При обычной температуре они обладают твердым агрегатным состоянием. Их электронная конфигурация имеет вид ns2.
Переходные металлы располагаются в побочных подгруппах. Они обладают переменными степенями окисления.
В низших степенях проявляются основные свойства, промежуточные степени выявляют кислотные свойства, а в высших степенях амфотерные.
Теоретическое определение неметаллов
В первую очередь, такие элементы обычно находятся в жидком или газообразном состоянии, иногда в твердом. При попытке согнуть их они ломаются по причине хрупкости. Неметаллы плохо проводят тепло и электрический ток.
Неметаллы находятся в верхней части диагональной линии, проведенной от бора до астата. В атомах неметаллов содержится большое количество электронов, из-за чего им выгоднее принимать дополнительные электроны, нежели отдавать. К неметаллам также относят водород и гелий.
Все неметаллы располагаются в группах со второй по шестую.
Химические способы определения
Есть несколько способов:
- Нередко приходится применять химические методы определения металлов. Например, нужно определить количество меди в сплаве. Для этого следует нанести каплю азотной кислоты на поверхность и через некоторое время пойдет пар. Промокните фильтрованную бумагу и подержите над колбой с аммиаком. Если пятно окрасилось в темно-голубой цвет, то это свидетельствует о наличии меди в сплаве.
- Предположим, что вам надо отыскать золото, но вы не хотите спутать его с латунью. Наносите на поверхность концентрированный раствор азотной кислоты в соотношении 1 к 1. Подтверждением большого количества золота в сплаве будет отсутствие реакции на раствор.
- Очень популярным металлом считается железо. Для его определения нужно нагреть кусочек металла в соляной кислоте. Если это действительно железо, то колба окрасится в желтый цвет. Если для вас химия довольно проблемная тема, то возьмите магнит. Если это действительно железо,то оно притянется к магниту. Никель определяется практически таким же методом, как и медь, только дополнительно капните диметилглиоксин на спирт. Никель подтвердит себя красным сигналом.
Похожими методами определяются и остальные металлические элементы. Просто используйте необходимые растворы и все получится.
Заключение
Периодическая таблица Менделеева — важный постулат химии. Она позволяет найти все необходимые элементы, в особенности металлы и неметаллы.
Если вы изучите некоторые особенности химических элементов, то сможете выявить ряд особенностей, помогающих отыскать необходимый элемент.
Также можно воспользоваться химическими способами определения металлов и неметаллов, так как они позволяют на практике изучить данную сложную науку. Удачи при изучении химии и периодической таблицы Менделеева, это поможет вам при дальнейших научных исследованиях!
Из видео вы узнаете, как определять металлы и неметаллы по таблице Менделеева.
Таблица Менделеева для чайников – HIMI4KA
Еще в школе, сидя на уроках химии, все мы помним таблицу на стене класса или химической лаборатории.
Эта таблица содержала классификацию всех известных человечеству химических элементов, тех фундаментальных компонентов, из которых состоит Земля и вся Вселенная.
Тогда мы и подумать не могли, что таблица Менделеева бесспорно является одним из величайших научных открытий, который является фундаментом нашего современного знания о химии.
Периодическая система химических элементов Д. И. Менделеева
На первый взгляд, ее идея выглядит обманчиво просто: организовать химические элементы в порядке возрастания веса их атомов. Причем в большинстве случаев оказывается, что химические и физические свойства каждого элемента сходны с предыдущим ему в таблице элементом.
Эта закономерность проявляется для всех элементов, кроме нескольких самых первых, просто потому что они не имеют перед собой элементов, сходных с ними по атомному весу.
Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме.
Разумеется, сегодня мы пользуемся понятием атомного числа (количества протонов) для того, чтобы упорядочить систему элементов. Это помогло решить так называемую техническую проблему «пары перестановок», однако не привело к кардинальному изменению вида периодической таблицы.
В периодической таблице Менделеева все элементы упорядочены с учетом их атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды в таблице называются периодами, а столбцы группами. В первой таблице, датируемой 1869 годом, содержалось всего 60 элементов, теперь же таблицу пришлось увеличить, чтобы поместить 118 элементов, известных нам сегодня.
Периодическая система Менделеева систематизирует не только элементы, но и самые разнообразные их свойства. Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
The ID of 1M7iKKVnPJE is invalid.
Периодический закон
Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.
Группы и периоды Периодической системы
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп.
Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов.
Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.
Свойства таблицы Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений.
В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы.
Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства. Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.
К ним относятся элементы из первой и второй группы периодической таблицы. Щелочные металлы из первой группы — мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним-единственным электроном на внешней оболочке и прекрасно вступают в реакцию.
Щелочноземельные металлы из второй группы также имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами.
По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
Показать / Скрыть текст
| Щелочные металлы | Щелочноземельные металлы |
| Литий Li 3 | Бериллий Be 4 |
| Натрий Na 11 | Магний Mg 12 |
| Калий K 19 | Кальций Ca 20 |
| Рубидий Rb 37 | Стронций Sr 38 |
| Цезий Cs 55 | Барий Ba 56 |
| Франций Fr 87 | Радий Ra 88 |
Лантаниды (редкоземельные элементы) и актиниды
Лантаниды — это группа элементов, изначально обнаруженных в редко встречающихся минералах; отсюда их название «редкоземельные» элементы.
Впоследствии выяснилось, что данные элементы не столь редки, как думали вначале, и поэтому редкоземельным элементам было присвоено название лантаниды. Лантаниды и актиниды занимают два блока, которые расположены под основной таблицей элементов.
Обе группы включают в себя металлы; все лантаниды (за исключением прометия) нерадиоактивны; актиниды, напротив, радиоактивны.
Показать / Скрыть текст
| Лантаниды | Актиниды |
| Лантан La 57 | Актиний Ac 89 |
| Церий Ce 58 | Торий Th 90 |
| Празеодимий Pr 59 | Протактиний Pa 91 |
| Неодимий Nd 60 | Уран U 92 |
| Прометий Pm 61 | Нептуний Np 93 |
| Самарий Sm 62 | Плутоний Pu 94 |
| Европий Eu 63 | Америций Am 95 |
| Гадолиний Gd 64 | Кюрий Cm 96 |
| Тербий Tb 65 | Берклий Bk 97 |
| Диспрозий Dy 66 | Калифорний Cf 98 |
| Гольмий Ho 67 | Эйнштейний Es 99 |
| Эрбий Er 68 | Фермий Fm 100 |
| Тулий Tm 69 | Менделевий Md 101 |
| Иттербий Yb 70 | Нобелий No 102 |
Галогены и благородные газы
Галогены и благородные газы объединены в группы 17 и 18 периодической таблицы. Галогены представляют собой неметаллические элементы, все они имеют семь электронов во внешней оболочке.
В благородных газахвсе электроны находятся во внешней оболочке, таким образом с трудом участвуют в образовании соединений. Эти газы называют «благородными, потому что они редко вступают в реакцию с прочими элементами; т. е.
ссылаются на представителей благородной касты, которые традиционно сторонились других людей в обществе.
Показать / Скрыть текст
| Галогены | Благородные газы |
| Фтор F 9 | Гелий He 2 |
| Хлор Cl 17 | Неон Ne 10 |
| Бром Br 35 | Аргон Ar 18 |
| Йод I 53 | Криптон Kr 36 |
| Астат At 85 | Ксенон Xe 54 |
| — | Радон Rn 86 |
Переходные металлы
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
Показать / Скрыть текст
| Переходные металлы |
| Скандий Sc 21 |
| Титан Ti 22 |
| Ванадий V 23 |
| Хром Cr 24 |
| Марганец Mn 25 |
| Железо Fe 26 |
| Кобальт Co 27 |
| Никель Ni 28 |
| Медь Cu 29 |
| Цинк Zn 30 |
| Иттрий Y 39 |
| Цирконий Zr 40 |
| Ниобий Nb 41 |
| Молибден Mo 42 |
| Технеций Tc 43 |
| Рутений Ru 44 |
| Родий Rh 45 |
| Палладий Pd 46 |
| Серебро Ag 47 |
| Кадмий Cd 48 |
| Лютеций Lu 71 |
| Гафний Hf 72 |
| Тантал Ta 73 |
| Вольфрам W 74 |
| Рений Re 75 |
| Осмий Os 76 |
| Иридий Ir 77 |
| Платина Pt 78 |
| Золото Au 79 |
| Ртуть Hg 80 |
| Лоуренсий Lr 103 |
| Резерфордий Rf 104 |
| Дубний Db 105 |
| Сиборгий Sg 106 |
| Борий Bh 107 |
| Хассий Hs 108 |
| Мейтнерий Mt 109 |
| Дармштадтий Ds 110 |
| Рентгений Rg 111 |
| Коперниций Cn 112 |
Металлоиды
Металлоиды занимают группы 13—16 периодической таблицы. Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
Показать / Скрыть текст
| Металлоиды |
| Бор B 5 |
| Кремний Si 14 |
| Германий Ge 32 |
| Мышьяк As 33 |
| Сурьма Sb 51 |
| Теллур Te 52 |
| Полоний Po 84 |
Постпереходными металлами
Элементы, называемые постпереходными металлами, относятся к группам 13—15 периодической таблицы. В отличие от металлов, они не имеют блеска, а имеют матовую окраску.
В сравнении с переходными металлами постпереходные металлы более мягкие, имеют более низкую температуру плавления и кипения, более высокую электроотрицательность. Их валентные электроны, с помощью которых они присоединяют другие элементы, располагаются только на внешней электронной оболочке.
Элементы группы постпереходных металлов имеют гораздо более высокую температуру кипения, чем металлоиды.
Показать / Скрыть текст
| Постпереходные металлы |
| Алюминий Al 13 |
| Галлий Ga 31 |
| Индий In 49 |
| Олово Sn 50 |
| Таллий Tl 81 |
| Свинец Pb 82 |
| Висмут Bi 83 |
Неметаллы
Из всех элементов, классифицируемых как неметаллы, водород относится к 1-й группе периодической таблицы, а остальные — к группам 13—18. Неметаллы не являются хорошими проводниками тепла и электричества. Обычно при комнатной температуре они пребывают в газообразном (водород или кислород) или твердом состоянии (углерод).
Показать / Скрыть текст
| Неметаллы |
| Водород H 1 |
| Углерод C 6 |
| Азот N 7 |
| Кислород O 8 |
| Фосфор P 15 |
| Сера S 16 |
| Селен Se 34 |
| Флеровий Fl 114 |
| Унунсептий Uus 117 |
А теперь закрепите полученные знания, посмотрев видео про таблицу Менделеева и не только.
Отлично, первый шаг на пути к знаниям сделан. Теперь вы более-менее ориентируетесь в таблице Менделеева и это вам очень даже пригодится, ведь Периодическая система Менделеева является фундаментом, на котором стоит эта удивительная наука.
Химические элементы металлы

Металлы — элементы, составляющие окружающую нас природу. Сколько существует Земля, столько существуют и металлы.
Земная кора содержит следующие металлы:
- алюминий — 8,2%,
- железо — 4,1%,
- кальций — 4,1%,
- натрий — 2,3%,
- магний — 2,3%,
- калий — 2,1 %,
- титан — 0,56% и т.д.
На данный момент наука обладает информацией о 118 химических элементах. Восемьдесят пять элементов из этого списка относятся к металлам.
Химические свойства металлов
Для того чтобы понять, от чего зависят химические свойства металлов, обратимся к авторитетному источнику – таблице периодической системе элементов, т.н. таблице Менделеева. Проведем диагональ (можно мысленно) между двумя точками: начнем от Be (бериллий) и закончим на At (астат).
Деление это конечно условно, но все-таки позволяет объединять химические элементы в соответствии с их свойствами. Элементы, находящиеся слева под диагональю, и будут металлами.
Чем левее, относительно диагонали, расположение элемента, тем более выражены будут у него металлические свойства:
- кристаллическая структура — плотная,
- теплопроводность — высокая,
- электрическая проводимость, уменьшающаяся с повышением температуры,
- уровень степени ионизации — низкий (электроны отделяются свободно)
- способность к образованию соединений (сплавы),
- растворимость (растворяются в сильных кислотах и едких щелочах),
- окисляемость (образование оксидов).
Вышеперечисленные свойства металлов зависят от наличия электронов, свободно перемещающихся в кристаллической решетке. У элементов, расположенных рядом с диагональю, или непосредственно в месте ее прохождения, имеют двойственные признаки принадлежности, т.е. имеют свойства металлов и неметаллов.
Радиусы атомов металлов имеют сравнительно большие размеры. Внешние электроны, называемые валентными, значительно удалены от ядра и, как следствие, слабо связаны с ним. Поэтому атомы металлов легко отдают валентные электроны и образуют положительно заряженные ионы (катионы).
Эта особенность является основным химическим свойством металлов. Атомы элементов с наиболее выраженными металлическими свойствами на внешнем энергетическом уровне имеют от одного до трех электронов.
Химические элементы с характерно выраженными признаками металлов образуют только положительно заряженные ионы, они совсем не способны присоединять электроны.
Вытеснительный ряд М. В. Бекетова
Активность металла и скорость реакции его взаимодействия с другими веществами зависит от величины показателя способности атома «расстаться с электронами». Способность различно выражена у разных металлов. Элементы, обладающие высокими показателями, являются активными восстановителями.
Чем больше масса атома металла, тем выше его восстановительная способность. Самыми сильными восстановителями считаются щелочные металлы K, Ca, Na. Если атомы металла не способны отдать электроны, то такой элемент будет считаться окислителем, например: аурид цезия может окислять другие металлы.
В этом отношении наиболее активны соединения щелочных металлов.
Русский ученый М. В. Бекетов первым начал изучать явление вытеснения одних металлов, из соединений образованных ими, другими металлами. Составленный им перечень металлов, в котором они расположены в соответствии со степенью увеличения нормальных потенциалов, получил название «электрохимического ряда напряжений» (вытеснительный ряд Бекетова).
Li K Rb Cs Ca Na Mg Al Mn Zn Cr Cr Fe Ni Sn Pb Cu Hg Ag Pt Ag Pt AuЧем правее расположен металла в этом ряду, тем ниже его восстановительные свойства, и тем сильнее окислительные свойства его ионов.
Классификация металлов по Менделееву
В соответствии с таблицей Менделеева различаются следующие виды (подгруппы) металлов:
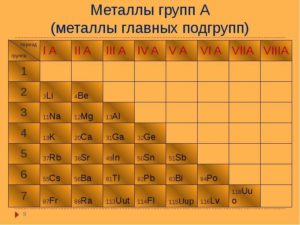
- щелочные — Li (литий), Na (натрий), K (калий), Rb (рубидий), Cs (цезий), Fr (франций);
- щелочноземельные – Be (бериллий), Mg (магний), Ca (кальций), Sr (стронций), Ba (барий), Ra (радий);
- легкие — AL (алюминий), In (индий), Cd (кадмий), Zn (цинк);
- переходные;
- полуметаллы
Техническое применение металлов
Металлы, нашедшие более или менее широкое техническое применение, условно делятся на три группы: черные, цветные и благородные.
К черным металлам относят железо и его сплавы: сталь, чугун и ферросплавы.
Следует сказать, что железо – самый распространенный в природе металл. Его химическая формула Fe (феррум). Железо сыграло огромную роль в эволюции человека. Человек смог получить новые орудия труда, научившись выплавлять железо. В современной промышленности широко применяются сплавы железа, полученные путём добавления в железо углерода или других металлов.
Цветные металлы – это практически все металлы за исключением железа, его сплавов и благородных металлов. По своим физическим свойствам цветные металлы классифицируют следующим образом:
· тяжёлые металлы: медь, никель, свинец, цинк, олово;
· лёгкие металлы: алюминий, титан, магний, бериллий, кальций, стронций, натрий, калий, барий, литий, рубидий, цезий;
· малые металлы: висмут, кадмий, сурьма, ртуть, кобальт, мышьяк;
· тугоплавкие металлы: вольфрам, молибден, ванадий, цирконий, ниобий, тантал, марганец, хром;
· редкие металлы: галлий, германий, индий, цирконий;
Благородные металлы: золото, серебро, платина, родий, палладий, рутений, осмий.
Нужно сказать, что с золотом человек познакомился гораздо раньше, чем с железом. Золотые украшения из этого металла делали ещё в Древнем Египте. В наше время золото используется ещё и в микроэлектронике и других отраслях промышленности.
Серебро, как и золото, используется в ювелирной промышленности, микроэлектронике, фармацевтической промышленности.
Металлы сопровождают человека на протяжении всей истории человеческой цивилизации. Нет такой отрасли, где не использовались бы металлы. Без металлов и их соединений невозможно представить современную жизнь.
Металлы и неметаллы в таблице Менделеева: таблица, как определять металлические свойства и отличать элементы

Дмитрий Менделеев смог создать уникальную таблицу химических элементов, главным достоинством которой была периодичность. Металлы и неметаллы в таблице Менделеева располагаются так, что их свойства изменяются периодическим образом.
Периодическая таблица Менделеева
Периодическая система была составлена Дмитрием Менделеевым во второй половине 19 века. Открытие не только позволило упростить работу химиков, она смогла объединить в себе как в единой системе все открытые химические вещества, а также предсказать будущие открытия.
Создание данной структурированной системы бесценно для науки и для человечества в целом. Именно это открытие дало толчок развитию всей химии на долгие годы.
Интересно знать! Существует легенда, что готовая система привиделась ученому во сне.
В интервью одному журналисту ученый объяснил, что работал над ней 25 лет и то, что она ему снилась – вполне естественно, но это не значит, что во сне пришли все ответы.
Созданная Менделеевым система делится на две части:
- периоды – столбики по горизонтали в одну или две строки (ряды);
- группы – вертикальные строчки, в один ряд.
Всего в системе 7 периодов, каждый следующий элемент отличен от предыдущего большим количеством электронов в ядре, т.е. заряд ядра каждого правого показателя больше левого на единицу.
Каждый период начинается с металла, а заканчивается инертным газом – именно это и есть периодичность таблицы, ведь свойства соединений меняются внутри одного периода и повторяются в следующем.
При этом, следует помнить, что 1-3 периоды неполные или малые, в них всего 2, 8 и 8 представителей. В полном периоде (т.е. оставшихся четырех) по 18 химических представителей.
В группе располагаются химические соединения с одинаковой высшей валентностью, т.е. у них одинаковое электронное строение. Всего в системе представлено 18 групп (полная версия), каждая из которых начинается щелочью и заканчивается инертным газом. Все, представленные в системе субстанции, можно разделить на две основные группы – металл или неметалл.
Для облегчения поиска группы имеют свое название, а металлические свойства субстанций усиливаются с каждой нижней строчкой, т.е. чем ниже соединение, тем больше у него будет атомных орбит и тем слабее электронные связи. Также меняется и кристаллическая решетка – она становится ярко выраженной у элементов с большим количеством атомных орбит.В химии используют три вида таблиц:
- Короткая – актиноиды и лантаноиды вынесены за границы основного поля, а 4 и все последующие периоды занимают по 2 строчки.
- Длинная – в ней актиноиды и лантаноиды вынесены за границу основного поля.
- Сверхдлинная – каждый период занимает ровно 1 строку.
Главной считается та таблица Менделеева, которая была принята и подтверждена официально, но для удобства чаще используют короткую версию. Металлы и неметаллы в таблице Менделеева располагаются согласно строгим правилам, которые облегчают работу с ней.
! Уроки химии: катионы и анионы – что это такое
Металлы в таблице Менделеева
В системе Менделеева сплавы имеют преобладающее число и список их весьма велик – они начинаются с Бора (В) и заканчиваются полонием (Po) (исключением являются германий (Ge) и сурьма (Sb)). У этой группы есть характерные признаки, они разделены на группы, но их свойства при этом неоднородны. Характерные их признаки:
- пластичность;
- электропроводимость;
- блеск;
- легкая отдача электронов;
- ковкость;
- теплопроводность;
- твердость (кроме ртути).
Из-за различной химической и физической сути свойства могут существенно отличаться у двух представителей этой группы, не все они похожи на типичные природные сплавы, к примеру, ртуть – это жидкая субстанция, но относится к данной группе.
В обычном своем состоянии она жидкая и без кристаллической решетки, которая играет ключевую роль в сплавах. Только химические характеристики роднят ртуть с данной группой элементов, несмотря на условность свойств этих органических соединений. То же самое касается и цезия – самого мягкого сплава, но он не может в природе существовать в чистом виде.
Некоторые элементы такого типа могут существовать только доли секунды, а некоторые не встречаются в природе совсем – их создали в искусственных условиях лаборатории. У каждой из групп металлов в системе есть свое название и признаки, которые отличают их от других групп.
! Уроки химии: что это такое галогены
При этом отличия у них весьма существенные. В периодической системе все металлы располагаются по количеству электронов в ядре, т.е. по увеличению атомной массы. При этом для них характерно периодическое изменение характерных свойств. Из-за этого в таблице они не размещаются аккуратно, а могут стоять неправильно.
В первой группе щелочей нет веществ, которые бы встречались в чистом виде в природе – они могут пребывать только в составе различных соединений.
Как отличить металл от неметалла?
Как определить металл в соединении? Существует простой способ определения, но для этого необходимо иметь линейку и таблицу Менделеева. Для определения надо:
- Провести условную линию по местам соединения элементов от Бора до Полония (можно до Астата).
- Все материалы, которые будут слева линии и в побочных подгруппах – металл.
- Вещества справа – другого типа.
! Что такое алканы: строение и химические свойства
Однако у способа есть изъян – он не включает в группу Германий и Сурьму и работает только в длинной таблице. Метод можно использовать в качестве шпаргалки, но чтобы точно определить вещество, следует запомнить список всех неметаллов. Сколько их всего? Мало – всего 22 вещества.
В любом случае, для определения природы вещества необходимо рассматривать его в отдельности. Легко будет элементы, если знать их свойства. Важно запомнить, что все металлы:
- При комнатной температуре – твердые, за исключением ртути. При этом они блестят и хорошо проводят электрический ток.
- У них на внешнем уровне ядра меньшее количество атомов.
- Состоят из кристаллической решетки (кроме ртути), а все другие элементы имеют молекулярную или ионную структуру.
- В периодической системе все неметаллы – красного цвета, металлы – черного и зеленого.
- Если двигаться слева направо в периоде, то заряд ядра вещества будет увеличиваться.
- У некоторых веществ свойства выражены слабо, но они все равно имеют характерные признаки. Такие элементы относятся к полуметаллам, например Полоний или Сурьма, они обычно располагаются на границе двух групп.
Внимание! В левой нижней части блока в системе всегда стоят типичные металлы, а в правой верхней — типичные газы и жидкости.
Важно запомнить, что при перемещении в таблице сверху вниз становятся сильнее неметаллические свойства веществ, поскольку там располагаются элементы, которые имеют отдаленные внешние оболочки. Их ядро отделено от электронов и поэтому они притягиваются слабее.
Подведем итоги
Отличить элементы будет просто, если знать основные принципы формирования таблицы Менделеева и свойства металлов. Полезно будет также запомнить и список остальных 22 элементов. Но не нужно забывать, что любой элемент в соединении следует рассматривать в отдельности, не учитывая его связей с другими веществами.
Металлы и различные неметаллы в периодической таблице Менделеева: признаки и свойства

> Химия > Металлы и неметаллы в периодической таблице Менделеева
Природа имеет некую цикличность и повторяемость в своих проявлениях. На это обращали внимание и древнегреческие ученые, когда пытались разложить природу вещей на составляющие: стихии, геометрические фигуры и даже атомы. На признаки повторяемости также обращают внимание и ученые современности. Например, Карл Линней на основе фенотипичного сходства смог выстроить систему живых существ.
…
- Металлы и их отличительные свойства
- Какие же признаки являются общими для всех металлов?
- Неметаллы
- Аллотропия
Долгое время химия как наука оставалась без системы, которая могла бы упорядочить великое множество открытых веществ. Знания древних алхимиков дали богатейший материал для построения такой системы. Многие учёные предпринимали попытки выстроить гармоничную схему, но все попытки оказались тщетными.
Так было вплоть до 1869 года, когда великий русский химик Дмитрий Иванович Менделеев представил миру своё детище — периодическую таблицу химических элементов. Говорят, что таблица приснилась учёному. Во сне он увидел, как таблица выстроилась в виде змеи и обвилась вокруг его ног.
Достоверность этого факта сомнительна, но как бы то ни было, это был настоящий прорыв в науке.
Менделеев расположил элементы по мере возрастания их атомной массы. Этот принцип актуален и сейчас, правда, сейчас в основе лежит количество протонов и нейтронов в ядре.
: анионы и катионы в химии, таблица растворимости.
Металлы и их отличительные свойства
Все химические элементы можно довольно условно поделить на металлы и неметаллы. Что же их отличает друг от друга? Как отличить металл от неметалла?
Из 118 открытых веществ 94 относят к группе металлов. Группа представлена разнообразными подгруппами:
- Щелочные
- Щелочноземельные
- Переходные металлы
- Легкие
- Полуметаллы
- Лантаноиды
- Актиноиды
- Неопределенные — Бериллий и Магний.
Какие же признаки являются общими для всех металлов?
- Все металлы при комнатной температуре являют твёрдыми веществами. Это справедливо для всех элементов, кроме ртути, которая тверда до минус 39 градусов Цельсия. В комнатных условиях ртуть — это жидкость.
- Большинство из элементов этой группы имеют довольно высокую температуру плавления.
Например, Вольфрам плавится при температуре 3410 градусов Цельсия. По этой причине его используют для изготовления нити в лампах накаливания.
- Все металлы пластичны. Это проявляется в том, что кристаллическая решетка металла позволяет атомам смещаться.
В результате металлы могут гнуться без физической деформации, поддаются ковке. Особой пластичностью обладают медь, золото и серебро. Именно поэтому исторически они были первыми металлами, которые обрабатывал человек. Далее он научился обрабатывать железо.
- Все металлы очень хорошо проводят электричество, что опять же связано со строением металлической кристаллической решетки, имеющей подвижные электроны. Кроме всего прочего, эти элементы очень легко проводят тепло.
- Ну и, наконец, все металлы имеют характерный, ни с чем не сравнимый металлический блеск.
Цвет чаще всего сероватой с голубым отливом. Au, Cu или Cs имеют желтый и красный оттенки.
Не пропустите: механизм образования металлической связи, конкретные примеры.
Аллотропия
Еще одно удивительное свойство неметаллов заключается в явлении, которое назвали аллотропией — видоизменение веществ, приводящее к различным аллотропным модификациям одного и того же химического элемента. С греческого можно перевести слово «аллотропия» как «другое свойство». Так оно и есть.
: типы кристаллических решеток — таблица различных материалов.
Рассмотрим более подробно на примере списка некоторых простых веществ:
- Водород — при различной температуре это вещество может быть в виде орто-водорода и пара-водорода.
- Углерод имеет огромное множество аллотропных модификаций — алмаз, графит, графен, карбин. Строение кристаллических решеток этих веществ различается.
- Фосфор — встречается более 11 модификаций этого вещества. Интересен тот факт, что при модификации цвет вещества также меняется. Наиболее известны белый, черный и красный фосфор. Белый фосфор наиболее реакционный — он может самовоспламеняться, светится в темноте. Необходимо помнить, что белый фосфор очень ядовит для человеческого организма. В связи с этим не рекомендуется держать в доме различные предметы с фосфором. В советские годы очень популярны были статуэтки оленей или птиц, выполненные с применением белого фосфора. Они, конечно, очень красивы, но при этом ядовиты.
- Кислород может существовать в виде формы О2 — это стандартный кислород, которым мы дышим, и О3 — озон. Озон — это не очень устойчивая форма. В стратосфере озон формирует озоновый экран, защищающий атмосферу от проникновения вредного солнечного ультрафиолета. Озон имеет особый запах, который мы ассоциируем с запахом свежести после грозы. По этому запаху можно определить озон. Дело в том, что под действием электрический разрядов в атмосфере образуются молекулы озона.
: как определить валентность по таблице Менделеева?
Модификации имеют и другие вещества — сера, селен, бор, мышьяк, бор, кремний, сурьма. При различных температурах многие металлы также обладают этими свойствами.
Конечно, деление всех простых веществ на группы металлов и неметаллов довольно условно. Это деление облегчает понимание свойств химических веществ, создает иллюзию их разделения на обособленные вещества. Как и все в мире, это деление относительное и зависит от внешних факторов окружающей среды — давления, температуры, света и т.д.